题目内容
下列有关金属的说法正确的是( )
| A、金属原子的核外电子在金属晶体中都是自由电子 |
| B、镁型和铜型的原子堆积方式空间利用率最高 |
| C、金属原子在化学变化中失去的电子数越多,其还原性越强 |
| D、金属导电的实质是金属阳离子在外电场作用下的定向移动 |
考点:金属晶体的基本堆积模型,金属晶体
专题:化学键与晶体结构
分析:A.金属原子的价电子在金属晶体中是自由电子;
B.镁型和铜型的原子堆积方式空间利用率最高;
C.金属原子在化学变化中失电子越容易,其还原性越强;
D.金属导电的实质是金属阳离子在外电场作用下定向移动.
B.镁型和铜型的原子堆积方式空间利用率最高;
C.金属原子在化学变化中失电子越容易,其还原性越强;
D.金属导电的实质是金属阳离子在外电场作用下定向移动.
解答:
解:A.金属原子的价电子在金属晶体中是自由电子,且被所有原子所共用,故A错误;
B.镁型和铜型的原子堆积方式空间利用率最高,为74%,故B正确;
C.金属原子在化学变化中失电子越容易,其还原性越强,与失电子多少无关,故C错误;
D.金属导电的实质是金属阳离子在外电场作用下定向移动而生成电流,故D错误;
故选B.
B.镁型和铜型的原子堆积方式空间利用率最高,为74%,故B正确;
C.金属原子在化学变化中失电子越容易,其还原性越强,与失电子多少无关,故C错误;
D.金属导电的实质是金属阳离子在外电场作用下定向移动而生成电流,故D错误;
故选B.
点评:本题考查了金属晶体的有关知识,明确金属晶体导电的原因、常见的金属晶体类型及空间利用率等知识点即可解答,易错选项是C,注意:金属性强弱与失电子多少无关、只与失电子难易程度有关,如Al失电子数大于Mg,而Al的金属性小于Mg,为易错点.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 2012年3月上海新闻栏目曾报道杭州世纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.结构简式如图所示:下列说法不正确的是( )
2012年3月上海新闻栏目曾报道杭州世纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.结构简式如图所示:下列说法不正确的是( )| A、该化合物的分子式为:C30H30O8 |
| B、1mol棉酚最多可与14mol H2加成,与6mol NaOH反应 |
| C、该物质可以与碳酸钠溶液反应 |
| D、该物质可以使酸性高锰酸钾溶液褪色 |
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A、非金属性:Z<T<X |
| B、R与Q原子核外电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:X>T |
下列离子方程式错误的是( )
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2 +6H+═2Mn2++5O2↑+8H2O |
| C、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ |
| D、铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
能正确表示下列反应的离子方程式的是( )
| A、Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
| B、NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol?L-1 NH4Cl溶液与0.1mol?L-1氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol?L-1 Na2CO3溶液与0.1mol?L-1 NaHCO3溶液等体积混合:
| ||
| D、0.1mol?L-1 Na2C2O4溶液与0.1mol?L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
当溶液中X
与H2O2分子个数比为2:5时,溶液中X
离子中X元素恰好被还原为较低价态,则X元素的化合价为( )
| O | - 4 |
| O | - 4 |
| A、+1 | B、+2 | C、+3 | D、+4 |
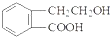 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.