题目内容
已知还原性Fe2+>Br一,向100mLFeBr2溶液中通入标准状况下的C126.72L,C12全部被还原,测得溶液中c(Br-)=c(C1-),则原FeBr2溶液的物质的量浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、3 mol/L |
| D、4 mol/L |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br-的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量=
=0.3mol,若Br-没有反应,溶液中n(Br-)=0.6mol,则n(FeBr2)=0.3mol,0.3molFe2+只能消耗0.15mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,表示出参加反应的n(Br-),根据电子转移守恒列方程计算x值,再根据c=
计算.
| 6.72L |
| 22.4L/mol |
| n |
| V |
解答:
解:还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br-的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量=
=0.3mol,若Br-没有反应,溶液中n(Br-)=0.6mol,则n(FeBr2)=0.3mol,0.3molFe2+只能消耗0.15mol的Cl2,故有部分Br-参加反应,
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.6 mol,参加反应的n(Br-)=(2x-0.6)mol,根据电子转移守恒有x×1+[2x-0.6]×1=0.3mol×2,解得x=0.4 mol,所以原FeBr2溶液的物质的量浓度为
=4mol/L.
故选D.
| 6.72L |
| 22.4L/mol |
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.6 mol,参加反应的n(Br-)=(2x-0.6)mol,根据电子转移守恒有x×1+[2x-0.6]×1=0.3mol×2,解得x=0.4 mol,所以原FeBr2溶液的物质的量浓度为
| 0.4mol |
| 0.1L |
故选D.
点评:本题考查反应方程式的计算,难度中等,判断Br-是否完全反应是解题的关键,注意还原性Fe2+>Br-,通入的Cl2后发生反应有先后顺序.

练习册系列答案
相关题目
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A、非金属性:Z<T<X |
| B、R与Q原子核外电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:X>T |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol?L-1 NH4Cl溶液与0.1mol?L-1氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol?L-1 Na2CO3溶液与0.1mol?L-1 NaHCO3溶液等体积混合:
| ||
| D、0.1mol?L-1 Na2C2O4溶液与0.1mol?L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
生活处处有化学.下列说法正确的是( )
| A、制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
已知某有机物的结构简式为: ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )
①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
 ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
| A、①③④⑤ | B、②③④⑥ |
| C、①③⑤ | D、①②③④⑤⑥ |
下列各组混合物,可以用分液漏斗分离的是( )
| A、甲苯和水 | B、甲苯和苯 |
| C、溴乙烷与水 | D、苯与溴乙烷 |
当溶液中X
与H2O2分子个数比为2:5时,溶液中X
离子中X元素恰好被还原为较低价态,则X元素的化合价为( )
| O | - 4 |
| O | - 4 |
| A、+1 | B、+2 | C、+3 | D、+4 |
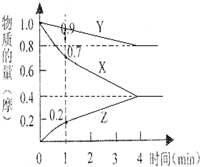 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为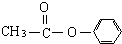 、
、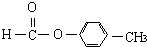 外还有四种,请分别写出结构简式:
外还有四种,请分别写出结构简式: