题目内容
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A、溶液中导电粒子的数目减少 |
| B、再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
| C、溶液中c(OH-)增大 |
| D、醋酸的电离程度增大,c(H+)亦增大 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加水稀释促进醋酸电离,氢离子和醋酸根离子数目增加;
B.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L;
C.溶液中Kw=c(OH-)×c(H+)为常数;
D.加水稀释促进醋酸电离,但氢离子浓度减小.
B.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L;
C.溶液中Kw=c(OH-)×c(H+)为常数;
D.加水稀释促进醋酸电离,但氢离子浓度减小.
解答:
解:A.加水稀释促进醋酸电离,氢离子和醋酸根离子数目增加,则溶液中导电粒子的数目增加,故A错误;
B.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L,两种溶液等体积混合,醋酸有剩余,溶液呈酸性,故B错误;
C.加水稀释时,c(H+)减小,因K=c(H+)×c(OH-)不变,则c(OH-)增大,故C正确;
D.加水稀释促进醋酸电离,溶液中氢离子个数增大程度小于溶液体积增大程度,所以氢离子浓度减小,故D错误;
故选C.
B.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L,两种溶液等体积混合,醋酸有剩余,溶液呈酸性,故B错误;
C.加水稀释时,c(H+)减小,因K=c(H+)×c(OH-)不变,则c(OH-)增大,故C正确;
D.加水稀释促进醋酸电离,溶液中氢离子个数增大程度小于溶液体积增大程度,所以氢离子浓度减小,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,加水稀释促进醋酸电离,但氢离子浓度降低,很多同学往往认为“促进电离,氢离子浓度增大”而导致错误,为易错点.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A、非金属性:Z<T<X |
| B、R与Q原子核外电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:X>T |
下列离子方程式错误的是( )
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2 +6H+═2Mn2++5O2↑+8H2O |
| C、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ |
| D、铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
能正确表示下列反应的离子方程式的是( )
| A、Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O |
| B、NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
下列关于某些问题的说法中,正确的是( )
| A、禁用含铅汽油是为了提高汽油的燃烧效率 |
| B、甲醇与乙醇是同系物,所以酒中含有甲醇是允许饮用的 |
| C、甲醛的水溶液可用于防腐,所以可以食用用甲醛浸泡过的动物内脏 |
| D、“白色污染”是指聚乙烯等塑料垃圾 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol?L-1 NH4Cl溶液与0.1mol?L-1氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol?L-1 Na2CO3溶液与0.1mol?L-1 NaHCO3溶液等体积混合:
| ||
| D、0.1mol?L-1 Na2C2O4溶液与0.1mol?L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
生活处处有化学.下列说法正确的是( )
| A、制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
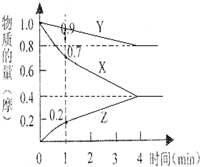 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为