题目内容
5.对于化学反应方向的确定,下列说法正确的是( )| A. | 在温度、压强一定的条件下,仅熵因素决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加反应一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |
分析 焓变、熵变均影响反应进行的方向,△H-T△S<0 的反应可自发进行,△H-T△S>0时不能自发进行,以此来解答.
解答 解:A.在温度、压强一定的条件下,熵变、焓变因素共同决定一个化学反应的方向,故A错误;
B.温度、压强一定时,放热的熵增加反应,△H-T△S<0,则反应一定能自发进行,故B正确;
C.反应焓变是决定反应能否自发进行的因素之一,单独使用焓变判断反应进行的方向不全面,故C错误;
D.固体的溶解过程,混乱度增大,则熵变增大,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握焓变、熵变判断反应进行的方向为解答的关键,侧重分析与应用能力的考查,注意综合判据的应用及单一判据不准确,题目难度不大.

练习册系列答案
相关题目
13.等物质的量的下列有机物,在相同条件下完全燃烧,耗氧量最多的是( )
| A. | C5H6 | B. | C4H6 | C. | C4H8O | D. | C5H6O2 |
20.等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述不正确的是( )
| A. | 金属Al无剩余 | B. | 有白色沉淀生成 | ||
| C. | 所得气体全部为氢气 | D. | Na的物质的量是0.6mol |
17.25℃时,用0.100mol/L的盐酸滴定10.00mL0.100mol/L的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )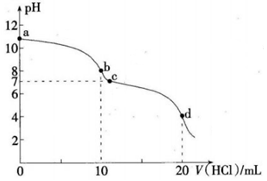

| A. | a、d 两点溶液中水电离出的c(H+):a<d | |
| B. | b点溶液存在:c(CO32-)+c(HCO3-)+c(H2CO3)=0.100mol/L | |
| C. | c点溶液存在:c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| D. | b点溶液加水稀释过程中,溶液的pH不断升高 |
14.燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放出热量为571.6kJ,表示H2燃烧热的热化学方程式为( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | ||
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8 kJ/mol | D. | H2(g)+O2(g)═H2O(g)△H=-285.8 kJ/mol |
15.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 1 LpH=l Ba(OH)2溶液中所含OH-的数目为0.2NA | |
| B. | 28g聚乙烯 中含有的碳原子数为2NA 中含有的碳原子数为2NA | |
| C. | 1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的数目为NA | |
| D. | 1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移的电子总数为NA |
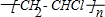 .
.