题目内容
6.硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃.(1)基态锌原子的价电子排布式是3d104s2.
(2)根据元素周期律,电负性Se<S,第一电离能Se<As(填“>”或“<”).
(3)H2Se的分子构型是V形,其中Se的杂化轨道类型是sp3杂化轨道.
(4)H2O的沸点>(填“>”或“<”)H2Se的沸点,其原因是:H2O分子间存在氢键.
(5)晶体Zn为六方最密堆积,其配位数是12.
(6)在硒化锌ZnSe晶胞中,Se2-离子作面心立方最密堆积,且Se2-与Se2-之间的最短距离为a nm,则晶胞边长为$\sqrt{2}$a nm.
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是0.25NA.
分析 (1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子;
(2)同一主族元素,元素电负性随着原子序数增大而减小;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式;
(4)含有氢键的氢化物熔沸点较高;
(5)晶体中Zn原子的配位数为12;
(6)Se2-离子作面心立方最密堆积,在立方体的各个面的对角线上3个Se2-彼此两两相切,据此计算晶胞边长;
(7)该晶胞中Zn原子个数为4、Se原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞质量=$\frac{79+65}{{N}_{A}}$,根据晶体质量与晶胞质量确定晶胞个数.
解答 解:(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为3d104s2,
故答案为:3d104s2;
(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性Se<S;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Se<Sn,
故答案为:<;<;
(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式分别为V形、sp3,
故答案为:V形;sp3;
(4)含有氢键的氢化物熔沸点较高,H2O含有氢键、H2Se不含氢键,导致H2O的沸点(100℃)高于H2Se的沸点(-42℃),
故答案为:>;H2O含有氢键、H2Se不含氢键;
(5)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图 可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,
故答案为:12;
(6)Se2-与Se2-之间的最短距离为a nm,对角线上三个Se2-相邻,对角线长度=4a,则晶胞棱长=$\sqrt{\frac{(4a)^{2}}{2}}$=2$\sqrt{2}$a,
故答案为:$\sqrt{2}$a;
(7)该晶胞中Zn原子个数为4、Se原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶胞质量=$\frac{79+65}{{N}_{A}}$g,晶胞个数=$\frac{144}{(\frac{79+65}{{N}_{A}}×4)}$=$\frac{{N}_{A}}{4}$=0.25NA,
故答案为:0.25NA.
点评 本题考查物质结构和性质,为高频考点,涉及核外电子排布式的书写、第一电离能、原子杂化方式判断、氢键、晶胞计算等知识点,侧重考查学生分析、判断、计算及空间想象能力,难点是晶胞计算及配位数计算,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| A. | 500mL 2mol•L-1MgCl2溶液 | B. | 500mL 2.5mol•L-1NaCl溶液 | ||
| C. | 300mL 2.5mol•L-1CaCl2溶液 | D. | 250mL 1mol•L-1AlCl3溶液 |
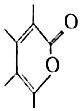 以下说法正确的是( )
以下说法正确的是( )| A. | 一Me基团的电子式为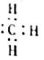 | |
| B. | 该合成过程的反应类型属于加成反应 | |
| C. | 产物与 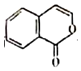 互为同分异构体 互为同分异构体 | |
| D. | 产物可与H2发生加成反应,反应的物质的量之比为1:3 |
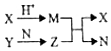 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
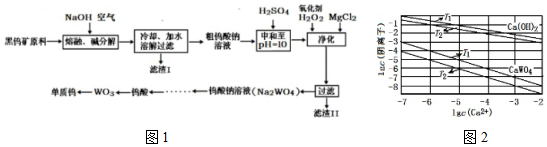
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是氧化HAsO32-生成HAsO42-,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4 .
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表.
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
WO2(s)+2H2(g)?W(s)+2H2O(g)△H=+66.0KJ•mol-1
WO2(s)?WO2(g)△H=+203.9KJ•mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为WO2(g)+2H2(g)?W(s)+2H2O(g△H=-137.9kJ•mol-1.
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小.不同温度下两种物质的沉淀溶解平衡曲线如图2,则T1时Ksp(CaWO4)=1×10-10.在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为1×103.
(5)利用电解法可以从碳化钨(WC)废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为WC+6H2O-10e-=H2WO4+CO2↑+10H+.
| A. | X、Y的最高价氧化物的水化物之间不能发生反应 | |
| B. | W、X两种元素形成的简单离子的半径大小顺序:X>W | |
| C. | 元素Q和Z能形成QZ2型的共价化合物 | |
| D. | Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
| A. | d的含氧酸是强酸 | |
| B. | 离子半径:d>c>b | |
| C. | b、c、d形成的化合物中只含离子键 | |
| D. | a、c形成的离子化合物具有还原性,可与水反应 |
| A. | 在温度、压强一定的条件下,仅熵因素决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加反应一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |