题目内容
14.燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放出热量为571.6kJ,表示H2燃烧热的热化学方程式为( )| A. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | ||
| C. | H2(g)+O2(g)═H2O(l)△H=-285.8 kJ/mol | D. | H2(g)+O2(g)═H2O(g)△H=-285.8 kJ/mol |
分析 4g H2的物质的量为$\frac{4g}{2g/mol}$=2mol,燃烧生成液态水时放出热量为571.6kJ,即1molH2燃烧生成液态水时放出热量为$\frac{571.6kJ}{2}$=-285.8 kJ,结合燃烧热为1mol氢气生成稳定氧化物来解答.
解答 解:4g H2的物质的量为$\frac{4g}{2g/mol}$=2mol,燃烧生成液态水时放出热量为571.6kJ,即1molH2燃烧生成液态水时放出热量为$\frac{571.6kJ}{2}$=-285.8 kJ,表示H2燃烧热的热化学方程式为H2(g)+O2(g)═H2O(l)△H=-285.8 kJ/mol,
故选C.
点评 本题考查热化学方程式,为高频考点,把握物质的量与热量的关系、燃烧热方程式书写为解答的关键,侧重分析与应用能力的考查,注意液态水比气态水稳定,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
15.短周期元素a、b、c、d分属三个周期,且原子序数依次增大.其中b与a、c两种元素均可形成原子个数比为1:1或1:2的化合物,a、c的原子具有相同的最外层电子数,b、d形成的一种化合物在工业上是一种新型自来水消毒剂.下列说法一定正确的是( )
| A. | d的含氧酸是强酸 | |
| B. | 离子半径:d>c>b | |
| C. | b、c、d形成的化合物中只含离子键 | |
| D. | a、c形成的离子化合物具有还原性,可与水反应 |
5.对于化学反应方向的确定,下列说法正确的是( )
| A. | 在温度、压强一定的条件下,仅熵因素决定一个化学反应的方向 | |
| B. | 温度、压强一定时,放热的熵增加反应一定能自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |
2.下列有关工业生产的叙述中正确的是( )
| A. | 硫酸工业中,为了提高SO2的转化率,使用五氧化二钒作催化剂 | |
| B. | 合成氨中通过及时分离液态氨来提高化学反应速率 | |
| C. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| D. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
9.某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
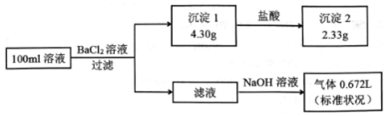

| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 是否存在Na+只有通过焰色反应才能确定 | |
| C. | 原溶液一定存在Na+,可能存在Cl- | |
| D. | 若原溶液中不存在Cl-,则c (Na+)=0.lmol•L-1 |
19.将过量的CO2分别通入
①CaCl2溶液
②Na2SiO3溶液
③Ca(ClO)2溶液
④饱和Na2CO3溶液
⑤NaAlO2 最终有沉淀析出的是( )
①CaCl2溶液
②Na2SiO3溶液
③Ca(ClO)2溶液
④饱和Na2CO3溶液
⑤NaAlO2 最终有沉淀析出的是( )
| A. | ②④⑤ | B. | ①②③④ | C. | ②③④⑤ | D. | ②③④ |
6.向恒温恒容的密闭容器中充入amolX和bmolY,发生反应X(g)+3Y(g)?2Z(g)达到平衡时,测得X和Y的转化率分别为25%和37.5%.则a:b为( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 1:2 |
3. 一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )
一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )
 一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )
一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代烃的种类共有( )| A. | 1种 | B. | 2种 | C. | 4种 | D. | 6种 |
 、
、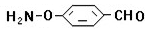 、
、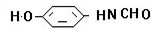 、
、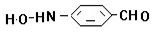 .
.