题目内容
17.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出,目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
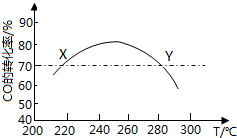
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).
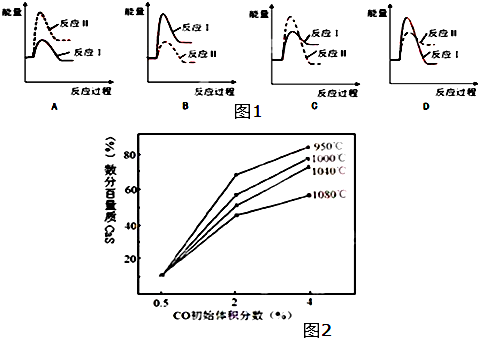
A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
分析 Ⅰ、(1)二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
(2)①由表格中的数据可知,HSO3-越多,酸性越强,则电离生成氢离子;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答;
Ⅱ、(1)根据盖斯定律结合已知方程式进行解答,反应热与化学计量数成正比;
(2)表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),可根据平衡常数的表达式书写,平衡常数等于气体生成物浓度幂之积除以气体反应物浓度幂之积;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,结合反应物与生成物总能量大小之间的关系判断;
(4)由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫.
解答 解:Ⅰ、(1)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,
故答案为:2OH-+SO2═SO32-+H2O;
(2)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3?SO32-+H+; HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,溶液显酸性,
故答案为:酸;溶液中存在HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,显酸性是因其电离大于其水解;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
A.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故A错误;
B.SO32-+H2O?HSO3-+OH-,HSO3-?H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故B正确;
C.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故C正确;
故答案为:BC;
Ⅱ、(1)CaSO4 (s)+CO (g)?CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)根据盖斯定律将反应Ⅰ×4-反应Ⅱ)得:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1,
故答案为:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1;
(2)由题意可知,平衡常数等于气体生成物二氧化硫、二氧化碳浓度幂之积除以气体反应物一氧化氮浓度幂之积,所以反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$,
故答案为:$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较小,则C错误、B正确,
故答案为:B;
(4)A.向该反应体系中投入生灰石,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,故A正确;
B.由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,则应在合适的温度区间内控制较低的反应温度,故B正确;
C.由图象可知,降低CO的初始体积百分数,减小CaS的质量分数,增加二氧化硫的排放,故C错误;
D.提高反应体系的温度,不利于二氧化硫的减少,故D错误;
故答案为:AB.
点评 本题考查了水解原理、离子浓度定性比较,盖斯定律计算、化学反应速率、平衡常数概念理解和计算应用,图象分析方法等,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H<0 | |
| C. | 反应温度应控制在260℃~280℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
| A. | 漂白粉 | B. | 水玻璃 | C. | CuSO4•5H2O | D. | Fe(OH)3胶体 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为
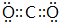 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为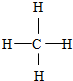 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.
| 实验方案 | 实验目的 | |
| A | 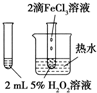 | 验证FeCl3对H2O2分解反应有催化作用 |
| B | 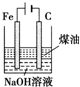 | 制备Fe(OH)2并能较长时间观察其颜色 |
| C | 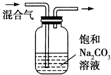 | 除去CO2气体中混有的SO2 |
| D | 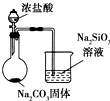 | 比较Cl、C和Si的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
 ;
;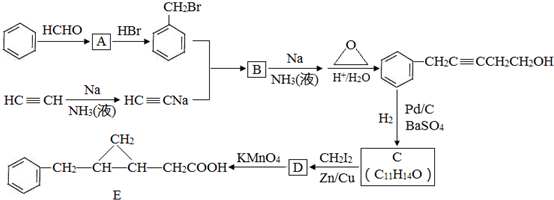
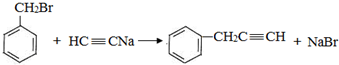 ,反应类型是取代反应.
,反应类型是取代反应.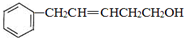 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个.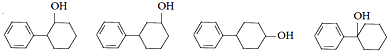 任意2种.
任意2种. .
. A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb
A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb .
.