题目内容
5.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为
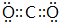 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为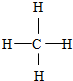 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.
分析 F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,则H为Na;C、E都有-2价,且C有最高正价+6,则C为S、E为O;D有-1价,原子半径大于氧,则D为Cl;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al,据此解答.
解答 解:F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,则H为Na;C、E都有-2价,且C有最高正价+6,则C为S、E为O;D有-1价,原子半径大于氧,则D为Cl;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al.
(1)C为S元素,处于周期表中第三周期第ⅥA族,B形成的简单离子为Al3+,离子结构示意图为 ,
,
故答案为:第三周期第ⅥA族; ;
;
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4,
故答案为:HClO4;
(3)A、D形成化合物为MgCl2,用电子式表示过程为: ,
,
故答案为: ;
;
(4)H、E形成原子个数比为1:1的化合物为Na2O2,所含化学键类型为离子键、共价键,
故答案为:离子键、共价键;
(5)CO2的电子式为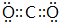 ,F与G形成的最简单的化合物为CH4,结构式为
,F与G形成的最简单的化合物为CH4,结构式为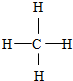 ,
,
故答案为: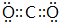 ;
;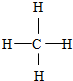 ;
;
(6)H2O分子间存在氢键,H2S分子间不存在氢键,故水的熔沸点较高,
故答案为:H2O分子间存在氢键,H2S分子间不存在氢键;
(7)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>Al>S>O,
故答案为:Mg>Al>S>O.
点评 本题考查结构性质位置关系,根据元素化合价与原子半径推断元素是解题关键,侧重对常用化学用语与元素周期律的考查,注意氢键对物质性质的影响,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | pH<7的溶液 | B. | c(H+)>c(OH-) 的溶液 | ||
| C. | c(H+)=1×10-7mol•L-1 | D. | c(H+)=c(OH-) 的溶液 |
| A. | 维生素C有还原性 | |
| B. | 天然油脂有固定的熔沸点 | |
| C. | 麦芽糖水解产物为还原性糖 | |
| D. | 氨基酸既能与盐酸反应又能与NaOH溶液反应 |
| A. | 二氧化碳和澄清石灰水反应 | B. | 实验室用双氧水制取氧气 | ||
| C. | 碳酸氢钠受热分解 | D. | 氧化铜和稀硫酸反应 |
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).
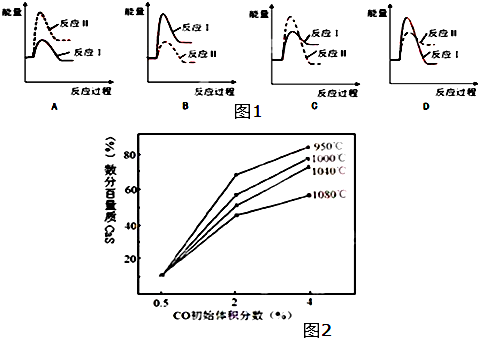
A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 氢键也是一种化学键 | D. | 离子化合物中一定含有金属离子 |
| A. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| B. | 由H2O2制得2.24 L O2,转移的电子数目为0.4 NA | |
| C. | 常温常压下,8 g O2与O3的混合气体中含有4 NA个电子 | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |