题目内容
12.下列图中的实验方案,能达到实验目的是( )| 实验方案 | 实验目的 | |
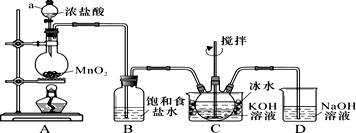
| A | 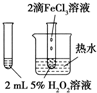 | 验证FeCl3对H2O2分解反应有催化作用 |
| B | 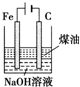 | 制备Fe(OH)2并能较长时间观察其颜色 |
| C |  | 除去CO2气体中混有的SO2 |
| D | 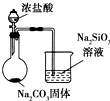 | 比较Cl、C和Si的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.要验证验证FeCl3对H2O2分解反应有催化作用,应该只有催化剂不同,其它条件必须完全相同;
B.亚铁离子和OH-反应生成Fe(OH)2,Fe(OH)2易被氧气氧化,所以要防止生成的Fe(OH)2被氧化;
C.二氧化碳、二氧化硫都能和碳酸钠溶液反应;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
解答 解:A.要验证验证FeCl3对H2O2分解反应有催化作用,应该只有催化剂不同,其它条件必须完全相同,该实验中催化剂、温度都不同,所以不能验证FeCl3对H2O2分解反应有催化作用,故A错误;
B.亚铁离子和OH-反应生成Fe(OH)2,Fe(OH)2易被氧气氧化,所以要防止生成的Fe(OH)2被氧化,Fe作阳极时生成亚铁离子进入溶液,亚铁离子和OH-反应生成Fe(OH)2,煤油能隔绝空气,防止氢氧化亚铁被氧化,故B正确;
C.二氧化碳、二氧化硫都能和碳酸钠溶液反应,应该用饱和的碳酸氢钠除去二氧化碳中的二氧化硫,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,HCl不是Cl元素的最高价氧化物的水化物,且生成的二氧化碳中含有挥发的HCl,HCl也和硅酸钠溶液而干扰二氧化碳的反应,所以该实验不能比较非金属性强弱,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、化学反应速率影响因素、除杂、非金属性强弱判断等知识点,明确实验原理、物质性质、实验基本操作是解本题关键,侧重考查学生实验操作、实验评价能力,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
3.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯(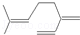 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲苯能使溴水和KMnO4溶液褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
20.下列反应属于氧化还原反应的是( )
| A. | 二氧化碳和澄清石灰水反应 | B. | 实验室用双氧水制取氧气 | ||
| C. | 碳酸氢钠受热分解 | D. | 氧化铜和稀硫酸反应 |
7.下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
17.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出,目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,显酸性是因其电离大于其水解.
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).
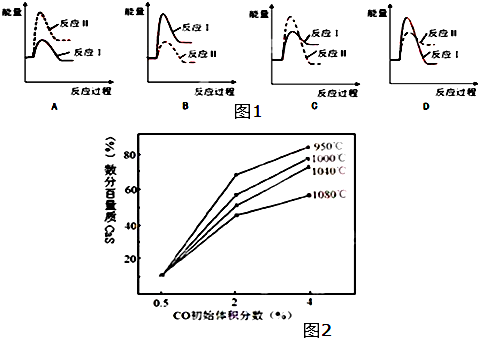
A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).

A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
4.增塑剂DCHP可由环己醇制得.DCHP和环已醇的结构简式如图所示,下列说法错误的是( )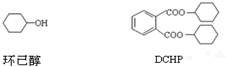

| A. | DCHP的分子式为C20H26O4 | |
| B. | 环己醇分子中所有碳原子不可能共平面 | |
| C. | DCHP的一氯取代物有5种 | |
| D. | DCHP通过取代反应可以得到环已醇 |
2.化学与生活密切相关,能使我们的生活更加美好,下列说法正确的是( )
| A. | 食用蛋白质可以为人体提供氨基酸 | |
| B. | 加碘盐中的碘是I2 | |
| C. | 袋装食品里放置的小袋硅胶是抗氧化剂 | |
| D. | 发酵粉中的小苏打是Na2CO3 |