题目内容
2.铜是与人类关系非常密切的有色金属.已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+═Cu2++Cu.大多数+1价铜的化合物是难溶物,如Cu2O、CuI、CuCl、CuH等.
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为砖红色,某同学实验时却有黑色物质出现,这种黑色物质的化学式为CuO.
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2+++4I-═2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-═2CuCl↓(白色)+I2.为顺利观察到白色沉淀可以加入的最佳试剂是B.
A.SO2 B.苯 C.NaOH溶液 D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH).
①已知NH5是离子化合物且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式:
 ;
;②写出CuH在过量稀盐酸中有气体生成的离子方程式:2CuH+2H+═Cu+Cu2++2H2↑;
③将CuH溶解在适量的稀硝酸中,完成下列化学方程式:
6CuH+16HNO3═6Cu(NO3)2+3H2↑+4NO↑+8H2O
(4)常温下,向0.20mol•L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH=6时,c(Cu2+)=2.2×10-4mol•L-1{已知:Ksp[Cu(OH)2]=2.2×10-20}.
分析 (1)葡萄糖分子中含有醛基,和新制氢氧化铜浊液加热反应生成砖红色沉淀Cu2O,黑色的物质的产生源于加热温度过高;
(2)碘水的颜色影响白色沉淀的观察,可以选用萃取剂把碘萃取出来;
(3)①NH5在所有原子都达到稀有气体的稳定结构,说明NH5是由NH4+和H-组成的离子化合物;
②CuH溶解在稀硫酸中,CuH中的H-失电子,硫酸中H+得电子,产生的气体为氢气,在酸性溶液中2Cu+=Cu2++Cu;
③发生氧化还原反应,还生成NO、水等;
(4)pH=6时,c(OH-)=10-8mol•L?1,结合Ksp[Cu(OH)2]计算.
解答 解:(1)葡糖糖是一个多羟基醛,能与新制氢氧化铜浊液加热反应生成砖红色沉淀Cu2O,如果加热温度过高,氢氧化铜受热分解为黑色的氧化铜(CuO)和水,
故答案为:砖红色;CuO;
(2)碘水是棕褐色的影响白色沉淀的观察,可以用苯把碘单质萃取出来,由于酒精与水以任意比例混溶,因此不能做萃取剂,
故答案为:B;
(3)①NH5在所有原子都达到稀有气体的稳定结构,即氮原子最外层达到8电子稳定结构,所有氢原子达到2电子稳定结构,说明NH5是由NH4+和H-组成的离子化合物,其电子式为 ,
,
故答案为: ;
;
②CuH溶解在稀硫酸中,CuH中的H-失电子硫酸中H+得电子,产生的气体为氢气,酸性溶液中2Cu+=Cu2++Cu,故离子方程式为:2CuH+2H+=Cu2++Cu+2H2↑
故答案为:2CuH+2H+=Cu2++Cu+2H2↑;
③稀硝酸被还原为NO,同时有水生成,1molCuH失去电子2mol,与NO的物质的量之比是3:2,反应为6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O,
故答案为:6、16、6、3、4、NO、8、H2O;
(4)pH=6时,c(OH-)=10-8mol•L?1,由Ksp[Cu(OH)2]=2.2×10-20mol3•L-3可知,c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-8})^{2}}$=2.2×10-4mol•L?1,
故答案为:2.2×10-4.
点评 本题考查较综合,涉及物质的性质、氧化还原反应及Ksp计算等,注重化学反应原理的考查,把握习题中的信息及迁移应用能力为解答的关键,题目难度不大.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
| A. | a+b-c | B. | c-3a-b | C. | 3a-b+c | D. | c-a-b |
| A. | 维生素C有还原性 | |
| B. | 天然油脂有固定的熔沸点 | |
| C. | 麦芽糖水解产物为还原性糖 | |
| D. | 氨基酸既能与盐酸反应又能与NaOH溶液反应 |
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).
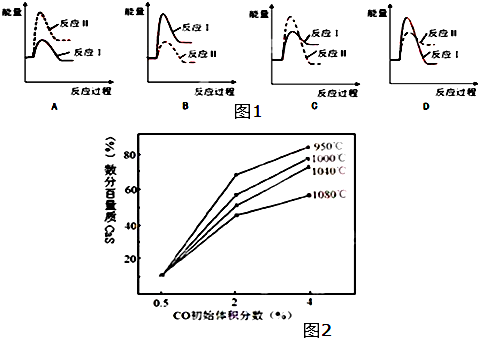
A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
| A. | BeCl2 | B. | H2O | C. | HCHO | D. | CS2 |
| A. | 离子化合物中可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 氢键也是一种化学键 | D. | 离子化合物中一定含有金属离子 |
①0.005mol•L-1 FeCl3溶液和0.015mol•L-1 KSCN溶液各1mL混合得到红色溶液
a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol•L-1 NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol•L-1 KSCN溶液2mL,溶液颜色先变深后变浅.
下列分析不正确的是( )
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
 钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+由A极区域移向B极区域 | |
| B. | 充电时,A为阴极,发生还原反应C6+xLi++xe-=LixC6 | |
| C. | 放电时,B为正极,电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“充电处理”使锂进入石墨中而有利于回收 |