题目内容
15.SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案: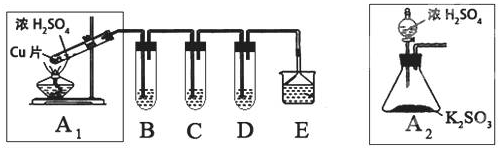
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为品红溶液,C中反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+.
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:①不用加热,安全性能高.②易于控制反应进行,反应更充分(任写一个)(任写一点即可).
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡. | |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 |
分析 (1)铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,检验二氧化硫漂白性可以通过品红试液;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;
(2)依据装置图对比分析不同,总结优点;
(3)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断.
解答 解:(1)依据装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,C检验二氧化硫的还原性,D检验二氧化硫的氧化性,检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的两种方程式为:SO2+I2+2H2O=SO42-+2I-+4H+;
故答案为:品红溶液; SO2+I2+2H2O=SO42-+2I-+4H+;
(2)装置图分析可知,A2的制取装置来代替A1装置,可以不需要加热,用分液漏斗加入硫酸可以控制反应速率,反应装置安全;
故答案为:①不用加热,安全性能高.②易于控制反应进行,反应更充分(任写一个);
(3)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断;实验设计方法和步骤为:
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),则“吸收液”中存在 SO32- 若品红不褪色(或无有气泡),则“吸收液”中不存在 SO32- |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡. | 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. 若不出现白色沉淀(或品红溶液不褪色,或没有气泡),则“吸收液”中不存在 HSO3-. |
| 实验操作 | 预期现象与结论 |
| 步骤2:滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡 | 若品红褪色(或有气泡),则“吸收液”中存在 SO32- 若品红不褪色(或无有气泡),则“吸收液”中不存在 SO32- |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡. | 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. 若不出现白色沉淀(或品红溶液不褪色,或没有气泡),则“吸收液”中不存在 HSO3-. |
点评 本题考查了二氧化硫性质的实验验证方法和实验设计分析步骤,掌握实验基础和离子性质、离子检验方法,正确选择试剂,描述反应现象,题目难度中等.

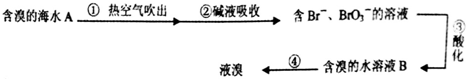
下列说法错误的是( )
| A. | ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3- | |
| B. | 第③步,需加人氧化性酸,才能将Br-氧化为Br2 | |
| C. | B溶液颜色要比A 溶液深 | |
| D. | 第④步,采用的是蒸馏的方法 |
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
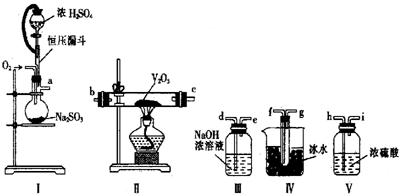
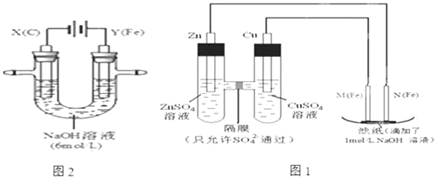
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.