题目内容
10.IBr、ICl、BrF3等称之为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似,请回答下列问题.(1)氯化碘(ICl)中碘元素的化合价为+1,它与水反应的化学方程式为ICl+H2O=HIO+HCl,该反应的反应类型为复分解反应(或非氧化还原反应)(填中学常见的无机反应类型);
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,发生反应的离子方程式为IBr+SO32-+H2O=I-+Br-+SO42-+2H+;
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-.现将几滴KSCN溶液滴入到含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象酸性高锰酸钾将SCN-氧化,减小了SCN-的浓度,使Fe3++3SCN-?Fe(SCN)3,平衡不断向左移动,最终Fe(SCN)3完全反应,红色消失;
②下列物质中,也可以使该溶液红色褪去的是AC;
A.新制氯水 B.碘水 C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法是:在碱性条件下用NaClO溶液将CN-氧化为CO32-和一种单质气体,该反应的离子方程式为2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2+H2O;
(5)已知HCN的电离平衡常数K=6.2×10-10,H2CO3的 电离平衡常数K1=4.5×10-7,K2=4.7×10-11,则下列离子方程式能发生的是AD.
A.CN-+CO2+H2O=HCN+HCO3-B.2HCN+CO32-=2CN-+CO2↑+H2O
C.2CN-+CO2+H2O=HCN+CO32-D.HCN+CO32-=CN-+HCO3-.
分析 (1)根据非金属性强弱判断氯化碘中I的化合价,ICl+H2O=HIO+HCl为复分解反应;
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,反应中IBr被还原,亚硫酸钠被氧化;
(3)①溶液中存在Fe3++3SCN-?Fe(SCN)3,高锰酸钾具有强氧化性,可氧化SCN-;
②能与SCN-或Fe3+反应的离子可使溶液褪色;
(4)碱性条件下CN-与NaClO反应生成N2、CO32-和Cl-;
(5)电离常数越大,酸性越强,应符合强酸制备弱酸的原理.
解答 解:(1)氯化碘中Cl的非金属性较强,Cl为-1价,I为+1价,ICl+H2O=HIO+HCl为复分解反应,故答案为:+1;复分解反应(或非氧化还原反应);
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,反应中IBr被还原,亚硫酸钠被氧化,反应的离子方程式为IBr+SO32-+H2O=I-+Br-+SO42-+2H+,
故答案为:IBr+SO32-+H2O=I-+Br-+SO42-+2H+;
(3)①溶液中存在Fe3++3SCN-?Fe(SCN)3,高锰酸钾具有强氧化性,可氧化SCN-,则酸性高锰酸钾将SCN-氧化,减小了SCN-的浓度,使Fe3++3SCN-?Fe(SCN)3,平衡不断向左移动,最终Fe(SCN)3完全反应,红色消失
故答案为:酸性高锰酸钾将SCN-氧化,减小了SCN-的浓度,使Fe3++3SCN-?Fe(SCN)3,平衡不断向左移动,最终Fe(SCN)3完全反应,红色消失;
②能与SCN-或Fe3+反应的离子可使溶液褪色,其中氯水与SCN-反应,二氧化硫与铁离子反应,
故答案为:AC;
(4)碱性条件下CN-与NaClO反应生成N2、CO32-和Cl-,反应的离子方程式为2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2+H2O,
故答案为:2CN-+5ClO-+2OH-=2CO32-+5Cl-+N2+H2O;
(5)已知HCN的电离平衡常数K=6.2×10-10,H2CO3的 电离平衡常数K1=4.5×10-7,K2=4.7×10-11,则酸性H2CO3>HCN>HCO3-,电离常数越大,酸性越强,应符合强酸制备弱酸的原理,只有AD符合.
故答案为:AD.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握题给信息以及相关物质的性质,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1L 0.2mol•L-1 醋酸 | B. | 0.1L 0.1mol•L-1 H2SO4溶液 | ||
| C. | 0.5L 0.1mol•L-1 盐酸 | D. | 2L 0.1mol•L-1 H2SO3溶液 |
| A. | 该离子反应配平后H2O的系数22 | |
| B. | MnO4-是氧化剂,既Cu2S是氧化剂又是还原剂 | |
| C. | 氧化性:MnO4-<Cu2+ | |
| D. | 生成2.24L(标况下)SO2时反应中转移电子的物质的量是0.6 mol |
| A. | 取样品mg,配成100ml溶液,取25.00mL于锥形瓶中,滴加几滴石蕊试液,用浓度为cmol/L的标准盐酸滴定至终点时,消耗盐酸Vml | |
| B. | 取样品mg,充分加热,冷却,称量固体的质量为n1g | |
| C. | 取样品mg,滴加足量的BaCl2溶液,过滤,洗涤,于燥后称量固体的质量为n2g | |
| D. | 取样品mg,滴加足量的Ba(OH)2过滤,洗涤,干燥后称量固体的质量为n3g |
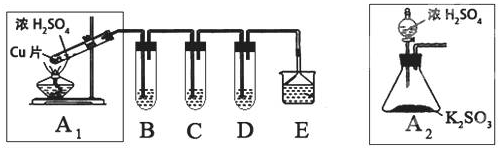
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为品红溶液,C中反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+.
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:①不用加热,安全性能高.②易于控制反应进行,反应更充分(任写一个)(任写一点即可).
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡. | |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 |
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |
| A. | 碳 | B. | 氧 | C. | 硅 | D. | 硫 |
