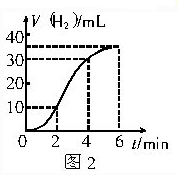
题目内容
3.工业上利用空气吹出法提取溴的部分流程如下: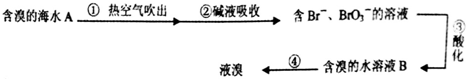
下列说法错误的是( )
| A. | ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3- | |
| B. | 第③步,需加人氧化性酸,才能将Br-氧化为Br2 | |
| C. | B溶液颜色要比A 溶液深 | |
| D. | 第④步,采用的是蒸馏的方法 |
分析 由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,加入碱液重新吸收,所得溶液富含BrO3-,③中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,以此来解答.
解答 解:A.纯碱是碳酸钠,与溴反应有BrO3-生成,反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,故A正确;
B.溶液中含有Br-、BrO3-,在酸性条件下可发生发生5Br-+BrO3-+6H+=3Br2+3H2O,无需加入氧化酸,故B错误;
C.B经过富集,浓度较大,则B的颜色比A深,故C正确;
D.溴的浓度较大,与水的沸点不同,可蒸馏分离,故D正确.
故选B.
点评 本题考查海水资源综合利用,涉及了离子的除杂、氧化还原反应、元素及其化合物的有关知识进行综合利用、混合物分离提纯及溴的制备,提高了试题的综合性,为高频考点,把握流程中的反应及物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法正确的是( )
| A. | CO2气体不能支持任何物质的燃烧 | |
| B. | 铝合金的硬度、熔点比组成合金各成分金属的大 | |
| C. | 将一小块钠放入足量AlCl3溶液中,最终有沉淀生成的 | |
| D. | 常温下,金属镁、铝在空气中都能与氧气反应,所以它们在空气中不能稳定存在 |
14.下列实验的设计不合理的是( )
| A. | 在浓氨水中加入生石灰可以制取少量的NH3 | |
| B. | 用水可以一次性鉴别溴苯、苯、乙酸三种物质 | |
| C. | 除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl | |
| D. | 实验室制备乙酸乙酯时,将溶液混合后需用大火迅速加热 |
11.下列物质的水溶液因水解而呈酸性的是( )
| A. | HCl | B. | NH4Cl | C. | CH3COONa | D. | NaHCO3 |
15.SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
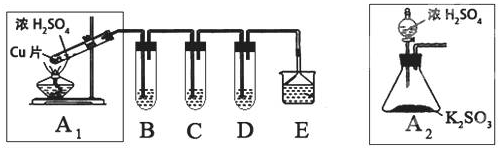
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为品红溶液,C中反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+.
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:①不用加热,安全性能高.②易于控制反应进行,反应更充分(任写一个)(任写一点即可).
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:

(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为品红溶液,C中反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+.
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:①不用加热,安全性能高.②易于控制反应进行,反应更充分(任写一个)(任写一点即可).
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴(或少量)品红,再滴入过量2mol/L盐酸,振荡. | |
| 步骤3:用试管取适量滤液,向其中(或小烧杯中)滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 |
12.向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列说法正确的是( )
| A. | 白色沉淀是CuI2,棕色溶液含有I2 | |
| B. | 滴加KI溶液时,转移1mol电子时生成1mol白色沉淀 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂 | |
| D. | 上述实验条件下,物质的氧化性:I2>Cu2+>SO2 |