题目内容
2.03年初春,“SARS病毒”在我国一些地区肆虐,它有极强的传染性,给我国的正常生活和经济建设带来很大的影响,全国人民万众一心,众志诚城,科学防控,在预防过程中,有一种消毒液(H2O2),据此材料,对过氧化氢的性质做出判断.从H2O2的分子组成及结构上分析,其( )| A. | 只具有氧化性 | B. | 只具有还原性 | ||
| C. | 既有氧化性也有还原性 | D. | 既无氧化性也无还原性 |
分析 过氧化氢中氧元素化合价-1价,元素化合价在化学变化中可以升高,也可以降低,氧元素化合价处于中间价态,既具有氧化性也具有还原性.
解答 解:从H2O2的分子组成及结构上分析,氧元素化合价-1价处于中间价态,既有氧化性也有还原性,故选C.
点评 本题考查了了物质性质、主要是元素化合价判断氧化性、还原性的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
10. 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | 该装置将化学能转化为光能和电能 |
17.根据下列实验方法和现象,得出结论正确的是( )
| A. | 某溶液$\stackrel{AgNO_{3}}{→}$生成白色沉淀,则原溶液中一定含有Cl- | |
| B. | 某溶液$\stackrel{BaCl_{2}}{→}$生成白色沉淀,则原溶液中一定含有SO42- | |
| C. | 某溶液$\stackrel{Na_{2}CO_{3}}{→}$有气体产生,则原溶液中一定含有H+ | |
| D. | 某溶液$\stackrel{稀HCl}{→}$有气体产生,则原溶液中一定含有CO32- |
7.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法不正确的是( )
| A. | 该反应中的还原剂是S2O32- | |
| B. | 该反应的氧化产物是Cl- | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
14.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用100 mL量筒量取12.5 mL盐酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 需用220 mL 1 mol•L-1 CuSO4溶液,配制时需称62.5g 的CuSO4•5H2O 晶体 | |
| D. | 所配得的500 mL 0.5mol•L-1 Na2CO3溶液中,Na+的物质的量浓度为0.5mol•L-1 |
12.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
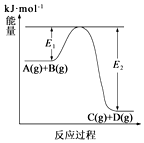

| A. | 上述反应为吸热反应 | B. | 上述反应的△H=E1kJ•mol-1 | ||
| C. | A(g)的能量一定大于C(g) | D. | 反应物的总焓大于反应产物的总焓 |
