题目内容
7.下列说法正确的是( )| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热和中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ |
分析 A.在101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物放出的热量为燃烧热;
B.氢离子与氢氧根离子生成1 mol水放出的热量为中和热;
C.燃烧热和中和热均属于反应热;
D.乙酸为弱酸,电离吸热.
解答 解:A.在101 kPa时,1 mol纯物质完全燃烧生成稳定氧化物放出的热量为燃烧热,而物质不一定为纯物质、且产物不一定为稳定氧化物时放出的热量不是燃烧热,故A错误;
B.氢离子与氢氧根离子生成1 mol水放出的热量为中和热,若酸为浓硫酸,中和反应生成1 mol水,放出的热量多于中和热的数值,故B错误;
C.燃烧热和中和热均属于反应热,则燃烧热和中和热是反应热的种类之一,故C正确;
D.乙酸为弱酸,电离吸热,则在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为小于57.3 kJ,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握燃烧热、中和热的概念及判断为解答的关键,侧重分析与应用能力的考查,注意中和热判断为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.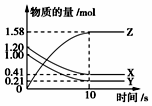 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
13.表实验中,所采取的分离或提纯方法与对应原理都正确的是( )
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |
2.(1)恒温,容积为1L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示(已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1),请回答下列问题:
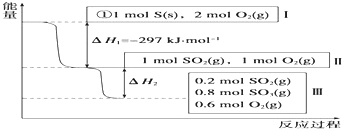
①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②在相同条件下,充入1mol SO3和0.5mol 的O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.
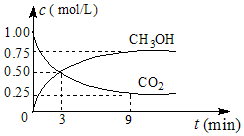
②能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是ABC.
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.

①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②在相同条件下,充入1mol SO3和0.5mol 的O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66KJ的能量.
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.

②能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是ABC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
17.根据下列实验方法和现象,得出结论正确的是( )
| A. | 某溶液$\stackrel{AgNO_{3}}{→}$生成白色沉淀,则原溶液中一定含有Cl- | |
| B. | 某溶液$\stackrel{BaCl_{2}}{→}$生成白色沉淀,则原溶液中一定含有SO42- | |
| C. | 某溶液$\stackrel{Na_{2}CO_{3}}{→}$有气体产生,则原溶液中一定含有H+ | |
| D. | 某溶液$\stackrel{稀HCl}{→}$有气体产生,则原溶液中一定含有CO32- |
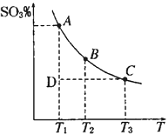 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
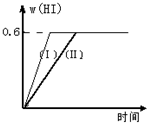 Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示: