题目内容
3.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的( )| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
分析 若反应向正反应进行到达平衡,X、Y的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X(气)+3Y(气)?2Z(气),
开始(mol/L):c1 c2 c3
变化(mol/L):0.04 0.12 0.08
平衡(mol/L):0.1 0.3 0.08
c1=0.14 c2=0.42 c3=0
若反应逆正反应进行到达平衡,X、Y的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X(气)+3Y(气)?2Z(气),
开始(mol/L):c1 c2 c3
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.1 0.3 0.08
c1=0 c2=0 c3=0.28
由于为可逆反应,物质不能完全转化所以起始时浓度范围为0<c(X)<0.14,0<c(Y)<0.42,0<c(Z)<0.28,以此解答该题.
解答 解:A.X 和Y平衡浓度为1:3,变化的量为1;3,所以起始量为1:3,c1:c2=1:3,故A错误;
B.平衡时,Y和Z的生成速率之比为化学方程式系数之比为2:3,故B错误;
C.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故C错误;
D.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则0<c1,如反应向逆反应分析进行,则c1<0.14mol•L-1,故有0<c1<0.14mol•L-1,故D正确.
故选D.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,本题注意化学平衡状态的判断方法以及可逆反应的特点,要掌握极值法在可逆反应中的应用.

| A. | 铝热反应 | B. | 煅烧石灰石 | ||
| C. | 硝酸铵的溶解 | D. | 高温下木炭还原二氧化碳 |
| A. | 该电池的电解质溶液为酸性 | B. | 电池总反应为2H2+O2=2H2O | ||
| C. | X极是负极,发生氧化反应 | D. | 电池工作一段时间后溶液PH增大 |
①太阳光催化分解水制氢:2H2O(1)═2H2(g)+O2(g)△H1=+571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ/mol( )
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | b | |||||
| 3 | c | d | e | f |
| A. | 元素 a 是制备一种高效电池的重要材料 | |
| B. | 由于分子间氢键的作用,同族中由 b 元素形成的氢化物沸点是最高的 | |
| C. | c、d 两元素的单质构成原电池两电极时,d 可能为负极 | |
| D. | e、f 的含氧酸的酸性依次增强 |
| A. | CO32-+Ba2+=BaCO3 | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-→H2O+BaCO3 | |
| D. | 2HCO3-+Ba2++OH-=BaCO3+2H2O+CO32- |
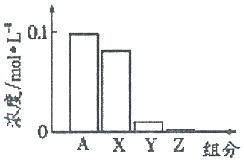 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
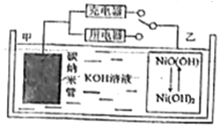 氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )
氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 可开发氢燃料电池用于电动汽车 | |
| C. | 电池总反应为H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2 | |
| D. | 充电时,乙电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH- |