题目内容
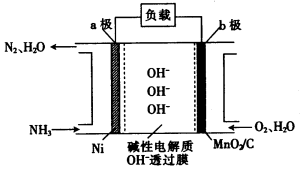
8.如图是元素周期表的一部分.
根据表中元素的位置,回答下列问题:
(1)元素②最外层有6个电子,最低负化合价为-2.
(2)元素③、④、⑦的简单离子中,半径最小的是Na+(填离子符号,下同),半径最大的是Cl-.
(3)元素②、⑥的单质与元素①的单质反应生成的化合物中,H2O(填化学式)更稳定,①、②形成的另一 种化合物可用于漂白,是利用其强氧化性.
(4)实验室中,元素⑤的氢氧化物可由铝盐与氨水反应生成,其氢氧化物能溶于表中④⑥⑦(填序号) 的最高价氧化物对应的水化物中.
分析 由元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)主族元素原子最外层电子数=族序数,最低负化合价=最外层电子数-8;
(2)电子层结构相同的微粒,核电荷数越大离子半径越小,离子的电子层越大离子半径越大;
(3)元素的非金属性越强,其氢化物越稳定;①、②形成的另一种化合物可用于漂白,该化合物为H2O2;
(4)实验室中利用铝盐与氨水反应制备氢氧化铝;氢氧化铝属于两性氢氧化物,溶于强酸、强碱.
解答 解:由元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl.
(1)元素②处于第二周期第VIA族,原子最外层有6个电子,最低负化合价为6-8=-2,
故答案为:6;-2;
(2)电子层结构相同的微粒,核电荷数越大离子半径越小,离子的电子层越大离子半径越大,故离子半径:Na+<O2-<Cl-,
故答案为:Na+;Cl-;
(3)非金属性O>S,故氢化物越稳定:H2O>H2S;①、②形成的化合物H2O2具有强氧化性,可用于漂白,
故答案为:H2O;强氧化性;
(4)元素⑤的氢氧化物为氢氧化铝,可由铝盐与氨水反应生成,氢氧化铝属于两性氢氧化物,溶于强酸、强碱,溶于表中Na、S、Cl的最高价氧化物对应的水化物,
故答案为:氨水;④⑥⑦.
点评 本题考查元素周期表与元素周期律,题目基础性强,贴近教材,需要学生熟练掌握短周期中各元素,掌握微粒半径比较规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.为确定下列置于空气中的物质是否变质,所选试剂(括号内的物质)不能达到目的是( )
| A. | 氯水(AgNO3溶液) | B. | NaOH溶液[Ba(OH)2溶液] | ||
| C. | FeSO4溶液(KSCN溶液) | D. | KI溶液(淀粉溶液) |
19.将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( )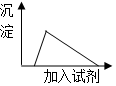

| A. | 该溶液中,Ag+、K+、NH4+、SO42-可以大量共存 | |
| B. | 该溶液中,Na+、OH-、NO3-、CO32-不能大量共存 | |
| C. | 向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 | |
| D. | 向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图 |
13.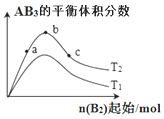 某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )
某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )
 某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )
某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )| A. | 反应速率a>b>c | |
| B. | 若T2>T1,则正反应一定是放热反应 | |
| C. | 达到平衡时,AB3的物质的量大小关系:c>b>a | |
| D. | 达到平衡时,A2转化率的大小关系:a>b>c |
4.想实现反应Cu+2H2O═Cu(OH)2+H2,下列方案可行的是( )
| A. | 电解池,阳极Pt,阴极用Cu,纯水做电解液 | |
| B. | 原电池,负极用Cu,正极用石墨,氯化钠溶液做电解液 | |
| C. | 电解池,阳极用Cu,阴极用石墨,H2SO4做电解液 | |
| D. | 电解池,阳极用Cu,阴极用石墨,Na2SO4做电解液 |
2.下列各组物质的性质顺序,不正确的是( )
| A. | 原子半径:K>Cl>Na | B. | 热稳定性:HF>H2O>PH3 | ||
| C. | 酸性强弱:HClO4>H2SO4>H3PO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |

 →
→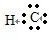
 .
.