题目内容
1.氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品.(1)等物质的量的氨和联氨分别与足量二氧化氮反应,产物为氮气和水.则转移的电子数之
比为3:4.
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂N-H、N-N及N≡N各1mol需吸收的能童依次为390.8kJ、193kJ、946kJ.若生成1mol N2,则反应放出(填“放出”或“吸收”)367kJ的能量.
(3)NH3-O2燃料电池的结构如图所示.
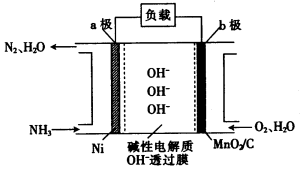
①a极为电池的负(填“正”或“负”)极.
②当生成1mol N2时,电路中流过电子的物质的量为6mol.
(4)联氨可以高效地脱除烟道气中的NO从而生成 N2,该反应中氧化产物与还原产物的物质的量之比为1:1.
分析 (1)NH3→N2,N元素化合价+3→0,故由1molNH3转化为N2得到3mol电子,N2H4→N2,N元素化合价+2→0,故由1molN2H4转化为N2得到4mol电子,据此进行分析;
(2)反应热=反应物总键能-生成物总键能;
(3)燃料电池中,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3-6e-+6OH-═N2+6H2O;正极上氧气得电子生成氢氧根离子,正极反应为:O2+4e-+2H2O=4OH-;溶液中阴离子向负极移动,据此分析;
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,依据原子守恒和氧化还原反应中元素化合价变化计算氧化产物和还原产物物质的量之比.
解答 解:(1)NH3→N2,N元素化合价+3→0,故由1molNH3转化为N2得到3mol电子,N2H4→N2,N元素化合价+2→0,故由1molN2H4转化为N2得到4mol电子,故等物质的量的氨和联氨分别与足量二氧化氮反应,产物为氮气和水.则转移的电子数之比为3:4,
故答案为:3:4;
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN-H、N-N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2,反应焓变△H=3×(193kJ/mol+390.8kJ×4KJ/mol)-946kJ/mol-4×3×390.8kJ/mol=-367KJ/mol,
故答案为:放出;367;
(3)该燃料电池中负极反应为:2NH3-6e-+6OH-═N2+6H2O,正极反应为:O2+4e-+2H2O=4OH-,则电池总反应为:4NH3+3O2═2N2+6H2O,
①a极通入燃料为负极,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3-6e-+6OH-═N2+6H2O,
故答案为:负;
②负极反应为:2NH3-6e-+6OH-═N2+6H2O,生成1mol氮气单质转移6mol,
故答案为:6mol;
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,反应的化学方程式为:N2H4+2NO=2N2+2H2O,反应中NO中氮元素化合价+2价变化为0价,得到还原产物,N2H4被氧化得到氮气为氧化产物,则反应中氧化产物与还原产物的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查热电子转移的数目求算、键能和反应的焓变计算、燃料电池的工作原理知识,注意知识的迁移应用是解题的关键,难度中等,明确原电池原理以及正负极的判断、电极方程式的书写是解题的关键.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| D. | 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料 |
| A. | 在0.1mol•L-1的碳酸钠溶液中存在5种微粒,且c(CO32-)+c(HCO3-)=0.1mol•L-1 | |
| B. | 硫化钠水解的离子方程式:S2-+2H2O?H2S+2OH- | |
| C. | FeSO4溶液中滴加次氯酸钠溶液:Fe2++ClO-+2H2O=Fe(OH)2↓+2HClO | |
| D. | AgNO3溶液中滴加足量NaCl溶液,再滴加NaI溶液,先产生白色沉淀后转化为黄色沉淀 |
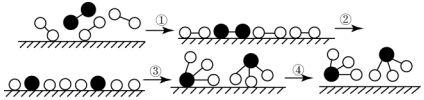
下列关于合成氨反应的叙述中不正确的是( )
| A. | 该过程表明,在化学反应中存在化学键的断裂与形成 | |
| B. | 在催化剂的作用下,反应物的化学键变得容易断裂 | |
| C. | 过程②需吸收能量,过程③则放出能量 | |
| D. | 常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
①Al2O3(S)+3C(S)═2Al(S)+3CO(g)△H1═+1344.1KJ•mol-1
②2AlCl3(g)═2Al(S)+3Cl2(g)△H2═+1169.2KJ•mol-1
③Al2O3(g)+3C(S)+3Cl2(g)═2AlCl3(g)+3CO(g)△H3═+QKJ•mol-1
下列有关说法正确的是( )
| A. | 反应①中化学能转化为热能 | |
| B. | 反应②中若生成液态铝则反应热应大于△H2 | |
| C. | 反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量 | |
| D. | 该生产工艺中能循环利用的物质只有A1C13 |
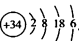 下列说法正确的是( )
下列说法正确的是( )| A. | Se位于第4周期第ⅣA族 | B. | 原子半径:Br>Se>P | ||
| C. | 热稳定性:HCl>H2Se>HBr | D. | 酸性:HClO4>HBrO4>H2SeO4 |
| A. |  用标准氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. | 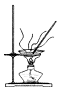 加热FeCl3溶液获取FeCl3固体 | |
| C. | 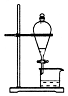 用酒精萃取碘水中的碘 | |
| D. | 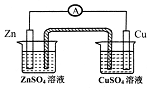 通过原电池原理证明金属性Zn>Cu |
