题目内容
3.下列关于胶体的说法中不正确的是( )| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 明矾净水过程中涉及化学变化 | |
| C. | Fe(OH)3胶体与食盐溶液混合将产生聚沉观象 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,可形成带正电荷的胶体 |
分析 A.江河入海口三角洲的形成是由于胶体的聚沉;
B.明矾净水是因为明矾电离生成的铝离子水解生成新物质氢氧化铝胶体具有吸附性;
C.胶体遇电解质发生聚沉;
D.胶体是电中性的分散系.
解答 解:A.江河水中的细小泥沙是胶体,遇到海水中的电解质发生了聚沉,日积月累,形成了三角洲,故A正确;
B.明矾净水过程有新物质氢氧化铝胶体生成,属于化学变化,故B正确;
C.Fe(OH)3胶体与食盐溶液发生聚沉生成沉淀氢氧化铁,故C正确;
D.沸水中滴加适量饱和FeCl3溶液加热至红褐色液体为氢氧化铁胶体,氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,故D错误.
故选D.
点评 本题考查胶体性质,胶体具有吸附性、丁达尔效应,聚沉,知道氢氧化铁胶体制备方法,难度不大.

练习册系列答案
相关题目
13.实验室可用如图所示的装置干燥、收集某气体R,则R可能是( )


| A. | SO2 | B. | NH3 | C. | CO2 | D. | Cl2 |
14.中国科学家屠呦呦因开创性地运用萃取的基本原理从中草药中分离出青蒿素并应用于疟疾治疗获得今年的诺贝尔医学奖.萃取实验中用到的主要仪器是( )
| A. | 长颈漏斗 | B. | 分液漏斗 | C. | 圆底烧瓶 | D. | 蒸馏烧瓶 |
11.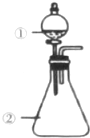 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
18.实验室制取下列气体,可用同一气体发生装置,并用相同收集方法的一组是( )
| A. | SO2和O2 | B. | H2和HCl | C. | H2S和HCl | D. | Cl2和HCl |
4.某探究小组废弃的印刷线路板(含Cu、Al少量Au、Pt等金属的混合物回收Cu并制备硫酸铝晶体[Al2(SO4)3•18H2O],设计路线如下:
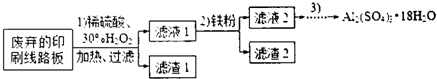
(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净.
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:
2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用Na2S2O3标准溶液润洗2~3次.
②滴定终点观察到的现象为溶液蓝色恰好褪去,且半分钟内不恢复.
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:滤液2$→_{过滤}^{适量Al粉}$滤液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
乙:滤液2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
①操作③的实验步骤依次为:蒸发浓缩:冷却结晶、过滤、洗涤.
②从原子利用率角度考虑,甲方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1•L-1计算).
①氧化需加入H2O2而不用Cl2的原因是不引入杂质,对环境无污染.
②调节溶液pH约为3.2~3.8.

(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净.
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:
2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用Na2S2O3标准溶液润洗2~3次.
②滴定终点观察到的现象为溶液蓝色恰好褪去,且半分钟内不恢复.
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:滤液2$→_{过滤}^{适量Al粉}$滤液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
乙:滤液2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
①操作③的实验步骤依次为:蒸发浓缩:冷却结晶、过滤、洗涤.
②从原子利用率角度考虑,甲方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
②调节溶液pH约为3.2~3.8.
8.为了探究氯水的成分,现实验如表:
(1)实验①得出的结论氯水中含有Cl-.
(2)指出实验②和实验③中的“实验现象”:
②有色布条褪色;③有气泡生成
(3)实验②的“实验现象”,同学们得出两个不同的结论.这两个结论可能是
a.Cl2具有漂白性,b.HClO具有漂白性.
请设计简单的实验证明哪一个是正确的用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①③实验无影响.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
(2)指出实验②和实验③中的“实验现象”:
②有色布条褪色;③有气泡生成
(3)实验②的“实验现象”,同学们得出两个不同的结论.这两个结论可能是
a.Cl2具有漂白性,b.HClO具有漂白性.
请设计简单的实验证明哪一个是正确的用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①③实验无影响.
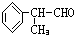
 .
. 、
、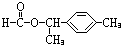 .
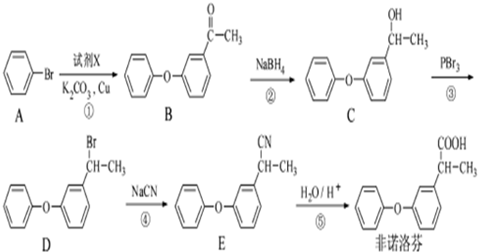
.
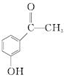 .
.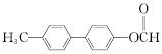 .
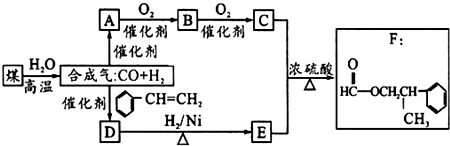
.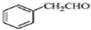 为原料制备
为原料制备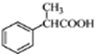 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: