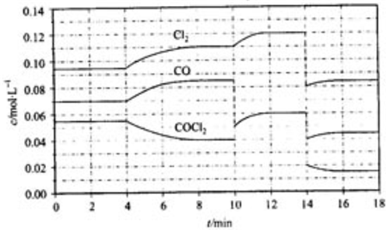
题目内容
4.某探究小组废弃的印刷线路板(含Cu、Al少量Au、Pt等金属的混合物回收Cu并制备硫酸铝晶体[Al2(SO4)3•18H2O],设计路线如下: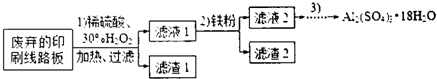
(1)过滤时所需要的玻璃仪器有玻璃棒、漏斗、烧杯.
(2)实验时需对滤渣2进行洗涤,判断洗涤是否干净的实验操作方法是取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净.
(3)为确定加入铁粉的量,实验中需测定滤液1中Cu2+的量.实验操作为:除去H2O2;准确量取一定体积滤液1于带塞锥形瓶中,加水稀释,调节溶液pH=3-4,加入过量KI-淀粉溶液,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式:
2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,再用Na2S2O3标准溶液润洗2~3次.
②滴定终点观察到的现象为溶液蓝色恰好褪去,且半分钟内不恢复.
③若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”)
(4)由滤液2制取硫酸铝晶体,探究小组设计了如下二种方案:
甲:滤液2$→_{过滤}^{适量Al粉}$滤液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
乙:滤液2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$\stackrel{操作3}{→}$Al2(SO4)3•18H2O
①操作③的实验步骤依次为:蒸发浓缩:冷却结晶、过滤、洗涤.
②从原子利用率角度考虑,甲方案更合理.(填“甲”或“乙”)
(5)他们查阅了资料,认为通过先氧化、再调节溶液pH也可将滤液2中的Fe2+除去.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mo1•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
②调节溶液pH约为3.2~3.8.
分析 (1)根据过滤操作方法判断所需要的玻璃仪器;
(2)根据检验洗涤液中是否含有硫酸根离子判断洗涤是否干净;
(3)①滴定管用蒸馏水洗完,必须使用装置液润洗;
②根据滴定终点的判断方法分析;
③根据双氧水具有氧化性,能够氧化碘离子分析对测定结果的影响;
(4)①可以经过加热蒸发、冷却结晶、过滤、洗涤操作,获得Al2(SO4)3•18H2O晶体;
②从原子利用率角度对甲和乙方案进行评价;
(5)①过氧化氢具有氧化性且被还原为水,无杂质无污染;
②根据表中铁离子沉淀完全、铝离子开始沉淀的pH判断调节溶液pH的范围.
解答 (1)过滤操作所需要的玻璃仪器有:玻璃棒、漏斗和烧杯,
故答案为:漏斗;烧杯;
(2)可以通过检验洗涤液中是否含有硫酸根离子的方法,判断滤渣2是否相等干净,操作方法为:取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净,
故答案为:取最后一次的洗涤液,加入氯化钡溶液和稀盐酸无白色沉淀出现,说明洗涤干净 (或其他合理答案);
(3)①滴定管在注入Na2S2O3标准溶液之前,要先用蒸馏水洗净,然后使用Na2S2O3标准溶液润洗2~3次,
故答案为:Na2S2O3标准溶液润洗2~3次;
②滴定终点前溶液为蓝色,滴定结束时溶液蓝色褪去,则滴定终点的现象为:溶液蓝色恰好褪去,且半分钟内不恢复,
故答案为:溶液蓝色恰好褪去,且半分钟内不恢复;
③由于双氧水能够氧化碘离子,使溶液中生成的碘单质物质的量增加,滴定时消耗的Na2S2O3标准溶液体积增大,导致测定的铜离子含量偏高,
故答案为:偏高;
(4)①滤液2为硫酸铝溶液,经过加热蒸发、冷却结晶、过滤洗涤操作,获得Al2(SO4)3•18H2O晶体,
故答案为:冷却结晶;过滤;
②从原子利用率和是否产生杂质考虑知,甲方案更合理,
故答案为:甲;
(5)①加H2O2的作用是将Fe2+氧化为Fe3+,反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染
,而氯气有毒,能够污染环境且反应后引进了杂质氯离子,
故答案为:不引入杂质,对环境无污染;
②由表中数据可知,铁离子沉淀完全的pH为3.2,铝离子开始沉淀的pH为3.8,所以应该调节溶液的pH范围为:3.2~3.8,
故答案为:3.2~3.8.
点评 本题通过制备硫酸铝晶体[A12(SO4)3.18H2O],考查了制备方案的设计,题目难度中等,涉及的知识点较多,充分考查了学生的分析、理解能力和灵活应用所学知识解决实际问题的能力.

①消耗盐酸的体积氢氧化钠比氨水多
②消耗盐酸的体积氨水比氢氧化钠多
③两种溶液所消耗盐酸的体积相同
④所得溶液中,c(OH-)=c(H+)
| A. | ①④ | B. | ③ | C. | ③④ | D. | ②④ |
| A. | 2:1:1 | B. | 6:1:1 | C. | 10:5:1 | D. | 15:5:2 |
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 明矾净水过程中涉及化学变化 | |
| C. | Fe(OH)3胶体与食盐溶液混合将产生聚沉观象 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,可形成带正电荷的胶体 |
| A. | Na+、Ag+、NO3-、Cl- | B. | K+、Ba2+、Cl-、CO32- | ||
| C. | Na+、Fe3+、NO3-、SO42- | D. | Na+、Mg2+、OH-、NO3- |