题目内容
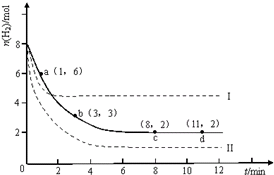 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).①下列时间段平均反应速率最大的是
A.0~1min B.1~3min C.3~8min D.8~11min
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是
③根据该反应的特点,此反应自发进行的条件是
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:①单位时间氢气的物质的量的变化量越大,表明平均速率越大,单位时间氢气的物质的量的变化量越小,平均反应速率越小;
②由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动;结合反应的特征进行分析;
③根据自发进行判断依据判断.
②由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动;结合反应的特征进行分析;
③根据自发进行判断依据判断.
解答:
解:①由图1可知,0~1min内氢气的变化量为8mol-6mol=2mol; B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol; C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;D.8~11min达平衡状态,氢气的物质的量不再变化.故1~3min速率增大,8~11min速率最小,
故答案为:A;D;
②对于可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强或者是增大CO2浓度;
③反应前气体体积大于反应后气体体积,即正反应方向为熵增加,根据△H-T?△S<0可知,温度较低有利于反应的自发进行,故答案为:低温.
故答案为:A;D;
②对于可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强或者是增大CO2浓度;
③反应前气体体积大于反应后气体体积,即正反应方向为熵增加,根据△H-T?△S<0可知,温度较低有利于反应的自发进行,故答案为:低温.
点评:本题考查化学平衡图象、反应速率大小判断、外界条件对平衡的影响等,题目难度不大,注意图象1中利用“先拐先平”,即曲线先折拐的首先达到平衡,以此判断温度或压强的高低,再依据外界条件对平衡的影响解答.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案
相关题目
 电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(
电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类( )作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
)作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )| A、放电时Li+移动方向与曲线①一致 |
| B、电解质溶液不能用醋酸溶液代替碳酸酯类 |
| C、充电时阴极反应式:Li++e-═Li |
| D、充电时b电极接电源的正极 |
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体.下列说法错误的是( )| A、S2Cl2的结构中各原子均达到8电子的稳定结构 |
| B、S2Cl2为含有极性键和非极性键的共价化合物 |
| C、若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2 |
| D、S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
下列离子方程式书写正确的是( )
| A、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
| B、NaHS溶液呈碱性:H3O++HS-?H2S+H2O |
| C、4mol/L的KAl(SO4)2溶液与7mol/L的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-═2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O |
| D、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
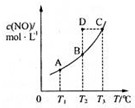 在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )| A、该反应的△H>0 |
| B、若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| C、在T2时,若反应体系处于状态D,则这时一定有v正<v负 |
| D、在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C |
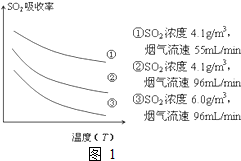 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.