题目内容
 电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(
电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类( )作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
)作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )| A、放电时Li+移动方向与曲线①一致 |
| B、电解质溶液不能用醋酸溶液代替碳酸酯类 |
| C、充电时阴极反应式:Li++e-═Li |
| D、充电时b电极接电源的正极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:放电时电极反应式为:S+2Li+2e-═Li2S,应为原电池的正极,发生还原反应,则a为负极,b为正极,放电时负极反应式为Li-e-=Li+,充电时,a为阴极,b为阳极,电极方程式与原电池电极方程式相反,以此解答该题.
解答:
解:放电时电极反应式为:S+2Li+2e-═Li2S,应为原电池的正极,发生还原反应,则a为负极,b为正极,
A.放电时Li+向正极移动,即向b移动,移动方向与曲线②一致,故A错误;
B.因锂可与醋酸反应,则电解质溶液不能用醋酸溶液代替碳酸酯类,故B正确;
C.充电时,阴极发生还原反应生成Li,电极方程式为Li++e-═Li,故C正确;
D.充电时b电极接电源的正极,发生氧化反应生成S,故D正确.
故选A.
A.放电时Li+向正极移动,即向b移动,移动方向与曲线②一致,故A错误;
B.因锂可与醋酸反应,则电解质溶液不能用醋酸溶液代替碳酸酯类,故B正确;
C.充电时,阴极发生还原反应生成Li,电极方程式为Li++e-═Li,故C正确;
D.充电时b电极接电源的正极,发生氧化反应生成S,故D正确.
故选A.
点评:本题综合考查原电池和电解池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,难度中等.

练习册系列答案
相关题目
根据热化学方程式:S(g)+O2(g)?SO2(g)△H=-QkJ?mol-1(Q>0),下列分析正确的是( )
| A、1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出QkJ的热量 |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ |
某醇烯酸是合成香精的主要原料,其结构简式为: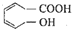 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )
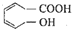 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )| A、该醇烯酸的分子式为C7H8O3 |
| B、既可以通过加聚反应形成高分子,也可以通过缩聚反应形成高分子 |
| C、不能使酸性高锰酸钾溶液褪色 |
| D、分子内能形成六元环的酯 |
下列现象与氢键有关的是:( )
①水结成冰体积膨胀,密度变小 ②水加热到很高温度都难以分解
③HF、HCl、HBr、HI的热稳定性依次减弱 ④对羟基苯甲醛的沸点高于邻羟基苯甲醛
⑤Cl2、Br2、I2单质熔点随相对分子质量增大而升高 ⑥NH3极易溶于水中.
①水结成冰体积膨胀,密度变小 ②水加热到很高温度都难以分解
③HF、HCl、HBr、HI的热稳定性依次减弱 ④对羟基苯甲醛的沸点高于邻羟基苯甲醛
⑤Cl2、Br2、I2单质熔点随相对分子质量增大而升高 ⑥NH3极易溶于水中.
| A、①④⑥ | B、①②③④⑤ |
| C、①④ | D、①②③ |
决定气体体积的主要微观因素是( )
| A、气体分子的数目和分子本身的大小 |
| B、气体分子的质量和分子本身的大小 |
| C、气体分子的数目和分子间的平均距离 |
| D、气体分子本身的大小和分子间的平均距离 |
下列有关物质性质的应用正确的是( )
| A、液氨汽化时要放出大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氧化铝是一种电解质,可用于制铝 |
下列因果关系叙述正确的是( )
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |



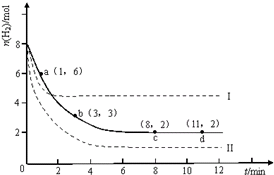 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).