题目内容
下列离子方程式书写正确的是( )
| A、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
| B、NaHS溶液呈碱性:H3O++HS-?H2S+H2O |
| C、4mol/L的KAl(SO4)2溶液与7mol/L的Ba(OH)2溶液等体积混合:4Al3++7SO42-+7Ba2++14OH-═2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O |
| D、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氨水过量,生成银氨溶液;
B.HS-水解显碱性;
C.等体积混合,物质的量比为4:7,碱不足,反应生成硫酸钡、氢氧化铝、偏铝酸钾、水;
D.HClO在离子反应中保留化学式.
B.HS-水解显碱性;
C.等体积混合,物质的量比为4:7,碱不足,反应生成硫酸钡、氢氧化铝、偏铝酸钾、水;
D.HClO在离子反应中保留化学式.
解答:
解:A.硝酸银溶液中滴加过量氨水的离子反应为Ag++3NH3?H2O═[Ag(NH3)2]++NH4++OH-+2H2O或Ag++2NH3?H2O═[Ag(NH3)2]++2H2O,故A错误;
B.NaHS溶液呈碱性的离子反应为H2O+HS-?H2S+OH-,故B错误;
C.4mol/L的KAl(SO4)2溶液与7mol/L的Ba(OH)2溶液等体积混合的离子反应为4Al3++7SO42-+7Ba2++14OH-═2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O,故C正确;
D.氯气溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故D错误;
故选C.
B.NaHS溶液呈碱性的离子反应为H2O+HS-?H2S+OH-,故B错误;
C.4mol/L的KAl(SO4)2溶液与7mol/L的Ba(OH)2溶液等体积混合的离子反应为4Al3++7SO42-+7Ba2++14OH-═2Al(OH)3↓+2AlO2-+7BaSO4↓+4H2O,故C正确;
D.氯气溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重水解、与量有关的离子反应考查,题目难度不大.

练习册系列答案
相关题目
下列因果关系叙述正确的是( )
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
2SO2+O2
2SO3是工业上制硫酸的反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、减少O2的浓度能加快反应速率 |
| B、降低体系温度能加快反应速率 |
| C、使用催化剂不影响反应速率 |
| D、一定条件下达到反应限度时SO2部分转化为SO3 |
下列关于化学反应速率的说法中正确的是( )
| A、决定化学反应速率的主要因素是温度 |
| B、反应速率用于衡量化学反应进行快慢 |
| C、可逆反应达到平衡状态时正逆反应的速率都为0 |
| D、增大反应物的量或提高反应温度一定能增大反应速率 |
对于常温下pH=12的氨水,下列说法正确的是( )
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
 2013年,全国出现多例人感染H7N9禽流感病毒,达菲(化学名:磷酸奥司他韦)一度受到人们的关注.如图为达菲的结构简式,下列说法不正确的是( )
2013年,全国出现多例人感染H7N9禽流感病毒,达菲(化学名:磷酸奥司他韦)一度受到人们的关注.如图为达菲的结构简式,下列说法不正确的是( )| A、可以用红外光谱仪测定达菲的某些官能团 |
| B、达菲的化学式为:C16H28N2O4?H3PO4 |
| C、达菲在一定条件下能与NaOH溶液反应 |
| D、达菲能与FeCl3溶液反应显紫色 |
 用0.1000mol?L-1的盐酸滴定10.00mL 0.1000mol?L-1的碳酸钠溶液,溶液pH值与加入盐酸的体积的关系如图所示.已知室温时饱和CO2的pH为3.9,0.05mol?L-1 NaHCO3的pH约为8.3.下列叙述中不正确的是( )
用0.1000mol?L-1的盐酸滴定10.00mL 0.1000mol?L-1的碳酸钠溶液,溶液pH值与加入盐酸的体积的关系如图所示.已知室温时饱和CO2的pH为3.9,0.05mol?L-1 NaHCO3的pH约为8.3.下列叙述中不正确的是( )| A、以酚酞为指示剂,溶液颜色突变时(A点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,当溶液颜色突变时,共消耗盐酸20.00mL |
| C、溶液pH=7时(B点),Na2CO3完全转化为NaCl |
| D、BC段对应溶液中CO2与NaHCO3共存 |
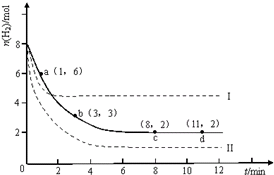 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).