题目内容
尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能.
(1)氮气的电子式为 ,雷电作用能进行氮的固定,写出反应方程式 .
(2)食物蕴含的营养物质中,含氮的高分子化合物是 (填名称),其水解的最终产物为 .
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3-,写出其离子方程式: .
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2L,再向溶液中加入过量氨水,充分反应后过滤.
①滤液显深蓝色是因为含有的离子(填化学式). .
②若沉淀质量为7.8g,则合金的质量为 g.
(1)氮气的电子式为
(2)食物蕴含的营养物质中,含氮的高分子化合物是
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3-,写出其离子方程式:
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2L,再向溶液中加入过量氨水,充分反应后过滤.
①滤液显深蓝色是因为含有的离子(填化学式).
②若沉淀质量为7.8g,则合金的质量为
考点:含氮物质的综合应用
专题:氮族元素
分析:(1)氮原子最外层5个电子,氮气中两个氮原子形成3对共用电子对;空气中的氮气与氧气在雷电的作用下发生反应生成一氧化氮;
(2)蛋白质是由氨基酸缩合而成的含氮的高分子化合物,蛋白质水解生成多肽化合物,多肽化合物水解最终产物为氨基酸;
(3)NH4+在硝化细菌的催化作用下被空气中的氧气氧化为硝酸根离子,依据得失电子守恒写出化学方程式;
(4)①过量氨水与铜离子发生反应生成深蓝色物质Cu(NH3)42+;
②铜铝合金与足量稀硝酸发生氧化还原反应,转化成硝酸铜和硝酸铝,部分硝酸得到电子被还原为NO,向反应后的溶液中加入过量的氨水,铜离子反应生成
Cu(NH3)42+;铝离子完全反应生成氢氧化铝沉淀,依据质量守恒和氧化还原反应中电子得失守恒计算解答.
(2)蛋白质是由氨基酸缩合而成的含氮的高分子化合物,蛋白质水解生成多肽化合物,多肽化合物水解最终产物为氨基酸;
(3)NH4+在硝化细菌的催化作用下被空气中的氧气氧化为硝酸根离子,依据得失电子守恒写出化学方程式;
(4)①过量氨水与铜离子发生反应生成深蓝色物质Cu(NH3)42+;
②铜铝合金与足量稀硝酸发生氧化还原反应,转化成硝酸铜和硝酸铝,部分硝酸得到电子被还原为NO,向反应后的溶液中加入过量的氨水,铜离子反应生成
Cu(NH3)42+;铝离子完全反应生成氢氧化铝沉淀,依据质量守恒和氧化还原反应中电子得失守恒计算解答.
解答:
解:(1)氮气中两个氮原子形成3对共用电子对,电子式为: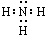 ;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2
;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2
2NO;
故答案为: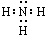 ;N2+O2
;N2+O2
2NO;
(2)蛋白质是由氨基酸缩合而成的含氮的高分子化合物,属于食物蕴含的营养物质中,含氮的高分子化合物是蛋白质;蛋白质水解生成多肽化合物,多肽化合物水解最终产物为氨基酸,所以蛋白质水解的最终产物为氨基酸,
故答案为:蛋白质;氨基酸;
(3)NH4+在硝化细菌的催化作用下被空气中的氧气氧化的离子方程式为:NH4++2O2
NO3-+H2O+2H+,
故答案为:NH4++2O2
NO3-+H2O+2H+;
(4)①过量氨水与铜离子发生反应生成深蓝色物质Cu(NH3)42+;所以滤液显深蓝色是因为含有的离子Cu(NH3)42+;
故答案为:Cu(NH3)42+;
②设合金中铜的物质的量为xmol,铝的物质的量为ymol,反应中铜失去电子变成二价铜离子,铝失去电子变成铝离子,硝酸中氮原子有+5价将为NO中的+2价,依据氧化还原反应中得失电子相等的规律则:
2x+3y=
×(5-2);
反应中铝最终全部变为氢氧化铝依据原子个数守恒得:
Al~Al(OH)3
1mol 78g
y 7.8g
y=0.1mol
带入2x+3y=
×(5-2)
解得:x=0.6mol
y=0.1mol
合金的质量=m(Mg)+m(Al)=0.6mol×64g/mol+0.1mol×27g/mol=41.1g
故答案为:41.1.
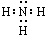 ;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2
;氮气与氧气在雷电的作用下发生反应生成一氧化氮,方程式为:N2+O2
| ||
故答案为:
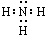 ;N2+O2
;N2+O2
| ||
(2)蛋白质是由氨基酸缩合而成的含氮的高分子化合物,属于食物蕴含的营养物质中,含氮的高分子化合物是蛋白质;蛋白质水解生成多肽化合物,多肽化合物水解最终产物为氨基酸,所以蛋白质水解的最终产物为氨基酸,
故答案为:蛋白质;氨基酸;
(3)NH4+在硝化细菌的催化作用下被空气中的氧气氧化的离子方程式为:NH4++2O2
| ||
故答案为:NH4++2O2
| ||
(4)①过量氨水与铜离子发生反应生成深蓝色物质Cu(NH3)42+;所以滤液显深蓝色是因为含有的离子Cu(NH3)42+;
故答案为:Cu(NH3)42+;
②设合金中铜的物质的量为xmol,铝的物质的量为ymol,反应中铜失去电子变成二价铜离子,铝失去电子变成铝离子,硝酸中氮原子有+5价将为NO中的+2价,依据氧化还原反应中得失电子相等的规律则:
2x+3y=
| 11.2L |
| 22.4L/mol |
反应中铝最终全部变为氢氧化铝依据原子个数守恒得:
Al~Al(OH)3
1mol 78g
y 7.8g
y=0.1mol
带入2x+3y=
| 11.2L |
| 22.4L/mol |
解得:x=0.6mol
y=0.1mol
合金的质量=m(Mg)+m(Al)=0.6mol×64g/mol+0.1mol×27g/mol=41.1g
故答案为:41.1.
点评:本题考查了氮及其化合物的性质,题目涉及到电子式的书写、化学方程式的书写、离子方程式的书写、硝酸的相关计算,综合性强,难度中等,易错点为第(4)②,解题的关键在于把握反应的过程,抓住氧化还原反应中得失电子守恒、原子个数守恒的规律.

练习册系列答案
相关题目
下列有关物质性质的应用正确的是( )
| A、液氨汽化时要放出大量的热,可用作制冷剂 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、氧化铝是一种电解质,可用于制铝 |
2SO2+O2
2SO3是工业上制硫酸的反应.下列关于该反应的说法正确的是( )
| 一定条件 |
| A、减少O2的浓度能加快反应速率 |
| B、降低体系温度能加快反应速率 |
| C、使用催化剂不影响反应速率 |
| D、一定条件下达到反应限度时SO2部分转化为SO3 |
对于常温下pH=12的氨水,下列说法正确的是( )
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
下列说法错误的是( )
| A、PM2.5又称细颗粒物,是指空气动力学当量直径小于等于2.5微米的颗粒物.因其粒径小,面积大,活性强,易附带有毒、有害物质(例如,重金属、微生物等),对人体健康和大气环境质量的影响更大 |
| B、“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2 |
| C、食品安全已成为各地政府和公众关注的热点话题,严禁向食品中添加任何非食用物质和滥用食品添加剂 |
| D、一氧化碳有毒,生有煤炉的居室,可放置数盆水,这样可有效地吸收一氧化碳,以防煤气中毒 |
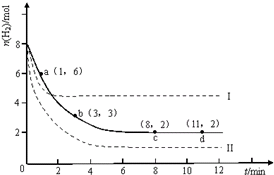 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).