题目内容
硼是广泛存在于自然界的非金属元素,硼及其化合物具有非常广泛的用途.
(1)工业上冶硼可用热还原法或电解法等.
已知:2Mg(s)+O2(g)═2MgO(s);△H1=-1204kJ?mol-1
4B(s)+3O2(g)═2B2O3(s);△H2=-2887kJ?mol-1
①写出Mg(s)还原B2O3(s)生成MgO(s)和B(s)的热化学方程式: .
②电解熔融B2O3(非电解质)及助熔剂,电解总反应为2B2O3
4B+3O2↑.则阴极的电极反应式为 .
(2)B4C是一种新型陶瓷,可由反应:2B2O3+7C
B4C+6CO↑合成,每7mol C参与反应,转移电子的物质的量为 .
(3)无机物B3N3H6是一种平面结构分子,有两种化学环境不同的氢,11BNMR谱只有一组峰,该无机物的结构式可能为 .
(4)0.1mol?L-1 Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-.
①Na2[B4O5(OH)4]水解反应的离子方程式为 .
②硼酸溶液电离出B(OH)4-的电离方程式为 .
③Na2[B4O5(OH)4]溶液中c(H3BO3) (填“>”“<”或“=”)c[B(OH)4-].
(1)工业上冶硼可用热还原法或电解法等.
已知:2Mg(s)+O2(g)═2MgO(s);△H1=-1204kJ?mol-1
4B(s)+3O2(g)═2B2O3(s);△H2=-2887kJ?mol-1
①写出Mg(s)还原B2O3(s)生成MgO(s)和B(s)的热化学方程式:
②电解熔融B2O3(非电解质)及助熔剂,电解总反应为2B2O3
| ||
(2)B4C是一种新型陶瓷,可由反应:2B2O3+7C
| ||
(3)无机物B3N3H6是一种平面结构分子,有两种化学环境不同的氢,11BNMR谱只有一组峰,该无机物的结构式可能为
(4)0.1mol?L-1 Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-.
①Na2[B4O5(OH)4]水解反应的离子方程式为
②硼酸溶液电离出B(OH)4-的电离方程式为
③Na2[B4O5(OH)4]溶液中c(H3BO3)
考点:热化学方程式,离子方程式的书写,氧化还原反应的电子转移数目计算,电解原理
专题:基本概念与基本理论,元素及其化合物
分析:(1)①利用盖斯定律解答;
②电解时阴极发生还原反应,据反应前后化合价变化书写;
(2)B2O3中B+3价,B4C中B+1价,C-4价,CO中C+2价,据得失电子守恒解答;
(3)B和N都是三键结构,B3N3H6是平面结构分子,有两种化学环境不同的氢,11BNMR谱只有一组峰,和苯环类似,以此推断;
(4)Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-,可据原子守恒写出①②的方程式;据Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-,结合②可知,H3BO3电离除生成B(OH)4-外还生成H+,会导致c(H+)增大,而溶液显碱性,应是B(OH)4-减少,水解生成B(OH)3和OH-.
②电解时阴极发生还原反应,据反应前后化合价变化书写;
(2)B2O3中B+3价,B4C中B+1价,C-4价,CO中C+2价,据得失电子守恒解答;
(3)B和N都是三键结构,B3N3H6是平面结构分子,有两种化学环境不同的氢,11BNMR谱只有一组峰,和苯环类似,以此推断;
(4)Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-,可据原子守恒写出①②的方程式;据Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-,结合②可知,H3BO3电离除生成B(OH)4-外还生成H+,会导致c(H+)增大,而溶液显碱性,应是B(OH)4-减少,水解生成B(OH)3和OH-.
解答:
解:(1)①已知:①2Mg(s)+O2(g)═2MgO(s);△H1=-1204kJ?mol-1
②4B(s)+3O2(g)═2B2O3(s);△H2=-2887kJ?mol-1
据盖斯定律,(①×3-②)÷2得:B2O3(s)+3Mg(s)═2B(s)+3MgO(s);△H=-362.5 kJ?mol-1,
故答案为:B2O3(s)+3Mg(s)═2B(s)+3MgO(s);△H=-362.5 kJ?mol-1;
②电解时阴极发生还原反应,生成B的反应为:B2O3+6e-═2B+3O2-,故答案为:B2O3+6e-═2B+3O2-;
(2)B2O3中B+3价,B4C中B+1价,C-4价,CO中C+2价,氧化产物只有CO,7molC生成6molCO时转移12mol电子,故答案为:12mol;
(3)B和N都是三键结构,B3N3H6是平面结构分子,有两种化学环境不同的氢,11BNMR谱只有一组峰,和苯环类似,N与B之间单双键交替,结构为
,故答案为: ;
;
(4)①Na2[B4O5(OH)4]能水解生成H3BO3和B(OH)4-,可据原子守恒和电荷守恒写出其水解方程式:B4O5(OH)42-+5H2O=2H3BO3+2B(OH)4-,
故答案为:B4O5(OH)42-+5H2O=2H3BO3+2B(OH)4-;
②硼酸电离出四羟基和硼酸根和氢离子,方程式为:H3BO3+H2O?B(OH)4-+H+,故答案为:H3BO3+H2O?B(OH)4-+H+;
③Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-,硼酸电离显酸性,四羟基和硼酸根离子水解显碱性,可见水解程度大,所以c(H3BO3)大,
故答案为:>.
②4B(s)+3O2(g)═2B2O3(s);△H2=-2887kJ?mol-1
据盖斯定律,(①×3-②)÷2得:B2O3(s)+3Mg(s)═2B(s)+3MgO(s);△H=-362.5 kJ?mol-1,
故答案为:B2O3(s)+3Mg(s)═2B(s)+3MgO(s);△H=-362.5 kJ?mol-1;
②电解时阴极发生还原反应,生成B的反应为:B2O3+6e-═2B+3O2-,故答案为:B2O3+6e-═2B+3O2-;
(2)B2O3中B+3价,B4C中B+1价,C-4价,CO中C+2价,氧化产物只有CO,7molC生成6molCO时转移12mol电子,故答案为:12mol;
(3)B和N都是三键结构,B3N3H6是平面结构分子,有两种化学环境不同的氢,11BNMR谱只有一组峰,和苯环类似,N与B之间单双键交替,结构为

,故答案为:
 ;
;(4)①Na2[B4O5(OH)4]能水解生成H3BO3和B(OH)4-,可据原子守恒和电荷守恒写出其水解方程式:B4O5(OH)42-+5H2O=2H3BO3+2B(OH)4-,
故答案为:B4O5(OH)42-+5H2O=2H3BO3+2B(OH)4-;
②硼酸电离出四羟基和硼酸根和氢离子,方程式为:H3BO3+H2O?B(OH)4-+H+,故答案为:H3BO3+H2O?B(OH)4-+H+;
③Na2[B4O5(OH)4]溶液pH约为9.6,能水解生成H3BO3和B(OH)4-,硼酸电离显酸性,四羟基和硼酸根离子水解显碱性,可见水解程度大,所以c(H3BO3)大,
故答案为:>.
点评:本题考查角度独到,有一定难度,特别是(3)的③,水解后产物水解导致溶液显碱性,不太适合学生练习.

练习册系列答案
相关题目
 硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )
硼化钒一空气电池是目前储电能力最高的电池,其示意图如图所示,该电池工作时的反应为4VB2+11O2═4B2O3+2V2O5.下列说法正确的是( )| A、电极X为电池负极 |
| B、OH-向电极X移动 |
| C、1mol VB2反应转移的电子数目是锂电池1mol Li反应转移的11倍 |
| D、VB2极的电极反应为2VB2+22e-+11H2O═2B2O3+V2O5+22OH- |
下列关于化学反应速率的说法中正确的是( )
| A、决定化学反应速率的主要因素是温度 |
| B、反应速率用于衡量化学反应进行快慢 |
| C、可逆反应达到平衡状态时正逆反应的速率都为0 |
| D、增大反应物的量或提高反应温度一定能增大反应速率 |
下列化学用语书写正确的是( )
A、CH4分子的比例模型: |
B、氯原子的结构示意图: |
C、NH3分子的电子式: |
| D、CS2结构式:S=C=S |




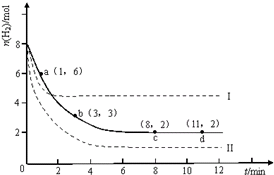 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).