题目内容
10.国际组织无机化学命名委员会将长式周期表原先的主副族族号取消,由左向右按原结构编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法不正确的是( )| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第14列元素形成化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 第17、18列元素都是非金属元素 |
分析 A.氦原子核外有2个电子,过渡元素的一些原子最外层电子数也是2;
B.第14列为ⅣA族,碳元素形成有机物的元素,形成物质最多;
C.第3列是第IIIB族,有镧系和锕系元素;
D.第17、18列分别对应ⅦA、零族.
解答 解:A.长式周期表原先的主副族族号取消,第2列即为原先的ⅡA族,最外层电子数为2,但最外层电子数为2个的不一定只在这一族,如He最外层为2个电子或某些过渡元素最外层也可能是2个,故A错误;
B.第14列为原先的ⅣA族,碳元素是形成化合物种类最多的元素,故B正确;
C.第三列为原先的ⅢB族,在第六、七周期分别出现了镧系和锕系所以元素种类最多,故C正确;
D.第17、18列分别对应ⅦA、零族,全部为非金属元素,故D正确;
故选A.
点评 本题考查元素周期表结构和元素周期律,为高频考点,明确元素周期表结构及元素在周期表中位置是解本题关键,注意规律中的反常现象,易错选项是A,熟练掌握元素周期表结构及元素位置.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
8.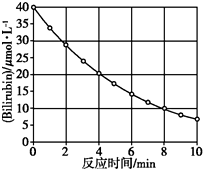 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
9.下列实验中,对应的现象以及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用洁淨铂丝蘸取少量待测液在酒精灯火焰上灼烧 | 火焰呈现黄色 | 待测液中只含Na+,不含K+ |
| B | 用铁作电极电解饱和食盐水 | 两极上均产生气体 | 阴、阳极分别生成H2和Cl2 |
| C | 向饱和氯水中加人少量石灰石 | 产生无色气体 | 酸性:HCl0>H2CO3 |
| D | 向Ca(ClO)2溶液中 通入足SO2 | 产生白色沉淀 | Ca(C1O)2具有氧化性,沉淀为CaSO4 |
| A. | A | B. | B | C. | C | D. | D |
6. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液用来吸收点解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,b极周围也会产生0.01mol气体 |
5. 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:
探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用 ①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究硫酸的浓度或氢离子浓度对化 学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液呈紫红色,达滴定终点紫色不再褪去.
(2)滴定时用b(填a或b)滴定管盛装KMnO4标准溶液.
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验①和④,可以研究硫酸的浓度或氢离子浓度对化 学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
(1)滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液呈紫红色,达滴定终点紫色不再褪去.
(2)滴定时用b(填a或b)滴定管盛装KMnO4标准溶液.
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
15.下列说法中正确的是( )
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | NaCl晶体由Na+和Cl-组成,NaCl晶体是电的良导体 | |
| C. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| D. | pH=3是醋酸稀释至100倍,pH=5 |
2.Si、SiO2广泛用于制造晶体管、光导纤维等.下列有关说法正确的是( )
| A. | 附着油污的晶体管可用碱液浸泡 | B. | 光导纤维遇碱会影响光信号传输 | ||
| C. | 工业上用S iO2热分解法冶炼硅 | D. | 自然界中硅以游离态形式存在 |
19.在含有大量K+、Mg2+、SO42-的溶液中,还可能大量存在的离子是( )
| A. | Ca2+ | B. | OH- | C. | Ba2+ | D. | NH${\;}_{4}^{+}$ |
20.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | $\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液中:Fe2+、K+、NO3-、SO42- | |
| B. | 使酚酞试液变红色的溶液中:Na+、Ba2+、NO3-、Cl- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、Cl-、SCN-、SO42- | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、Br-、HCO3- |