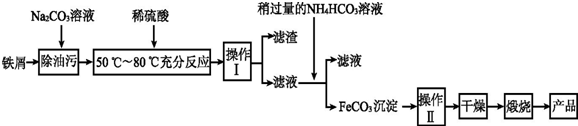
题目内容
5. 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:探究课题Ⅰ.“不同条件对化学反应速率影响的探究”,选用4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1 H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验①和④,可以研究硫酸的浓度或氢离子浓度对化 学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变.
探究课题Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数.该小组称量1.34g草酸钠样品溶于稀硫酸中,然后用0.200mol•L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应).
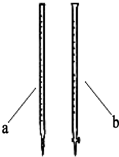
(1)滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液呈紫红色,达滴定终点紫色不再褪去.
(2)滴定时用b(填a或b)滴定管盛装KMnO4标准溶液.
(3)达到终点时消耗了15.00mL的高锰酸钾溶液,样品中草酸钠的质量分数为75%.
分析 Ⅰ.(1)探究反应物浓度、温度、催化剂对反应速率影响,需在其它条件相同,的条件下,对比实验;
(2)对比实验①和④,从提供的反应物的差异解答;
Ⅱ.(1)高锰酸钾为紫红色,过程中不需要加指示剂;
(2)高锰酸钾具有强氧化性;
(3)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据反应计算.
解答 解:Ⅰ.(1)由实验目的可知,探究反应物浓度、温度、催化剂对反应速率影响,需在相同的条件下对比实验,同浓度溶液,在相同温度下进行反应,①无催化剂,②有催化剂,对比实验;如果研究温度对化学反应速率的影响,需其它条件相同,温度不同,①有20℃,③中温度为30℃,能进行对照实验,
故答案为:①;②;①;③;
(2)对比实验①和④,10%硫酸的体积不同,其它物质,④中加入了蒸馏水,说明两组实验中的反应物的浓度不同,所以可通过探究反应物的浓度对化学反应速率的影响;对比实验①和④,Ⅳ中只加入1mL10%硫酸,与I中加入的溶液体积不等,就不能保证,4mL 0.01mol•L-1KMnO4溶液与2mL 0.1mol•L-1 H2C2O4溶液,反应物浓度相同,实验④中加入1mL蒸馏水的目的是保证了KMnO4溶液与H2C2O4溶液的起始浓度相同,
故答案为:硫酸的浓度或氢离子浓度;确保①和④组对比实验中c(KMnO4)、c(H2C2O4)浓度不变或确保溶液总体积不变;
Ⅱ.(1)高锰酸钾溶液为紫红色,当达到滴定终点时,再滴入高锰酸钾溶液时,紫红色不再褪去,
故答案为:否;KMnO4溶液呈紫红色,达滴定终点紫色不再褪去;
(2)高锰酸钾具有强氧化性,腐蚀橡皮管,应用酸式滴定管,
故答案为:b;
(3)草酸钠(Na2C2O4)溶于稀硫酸中,然后用酸性高锰酸钾溶液进行滴定,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O. n(KMnO4)=0.015L×0.200mol•L-1=3×10-3mol,根据方程式可得:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
2 5
3×10-3mol 7.5×10-3mol
样品中草酸钠的质量为:m=7.5×10-3mol×134g/mol=7.5×134×10-3g,
样品中草酸钠的质量分数为:$\frac{7.5×134×10-3g}{1.34g}$×100%=75%,
故答案为:75%.
点评 本题主要结合实验考查了外界条件对化学反应速率的影响、质量分数的计算,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握化学反应速率及其影响,试题培养了学生的分析能力及化学实验能力.

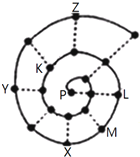 如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )| A. | Y元素对应的氢化物比Z元素对应的氢化物更稳定 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | M、K元素的离子半径大小顺序是M2+>K2- | |
| D. | 由K、L两种元素组成的化合物中不可能含有共价键 |
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 在油脂皂化反应实验中,用玻璃棒蘸取反应液滴入热水中,若无油滴浮于液面上,说明皂化反应已经完全 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化△t℃,反应液的比热容为c J•g-1•℃-1,则生成1mol水放出的热量为cm△t×10-3kJ | |
| D. | 同一温度下,可通过观察出现浑浊的快慢来探究浓度对Na2S2O3与稀硫酸反应速率的影响 |
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第14列元素形成化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 第17、18列元素都是非金属元素 |
| A. | 加水稀释,平衡左移,溶液颜色变浅 | |
| B. | 加入一定量的NaOH溶液,有红褐色沉淀产生,溶液颜色变浅 | |
| C. | 加入一定量的铁粉,充分振荡后,溶液颜色变浅 | |
| D. | 加入少量的KCl固体,平衡左移,溶液颜色变浅 |
| A. | 质子数是2 | B. | 质量数是1 | C. | 电子数是3 | D. | 中子数是2 |
| A. | 化石燃料脱硫、脱硝处理 | B. | 工业废水经处理达标排放 | ||
| C. | 废电子产品统一回收处理 | D. | 农作物秸秆就地露天焚烧 |