题目内容
6. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液用来吸收点解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,b极周围也会产生0.01mol气体 |
分析 A、氢氧燃料电池中,正极上放电的是氧气;
B、电子在导线中移动,不能在溶液中移动;
C、还原性:Br->Cl-,还原性强的离子在阳极先放电,氢氧化钠溶液吸收电解时产生的气体;
D、燃料电池和电解池中转移的电子数是相等的,据此计算回答.
解答 解:A、氢氧燃料电池中,正极上放电的是氧气,在酸性电解质环境下,电极反应式为:O2+4H++4e-═2H2O,故A错误;
B、电子在导线中移动,不能在溶液中移动,故B错误;
C、还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是Br-后放电的为Cl-,所以试管中NaOH溶液是用来吸收电解时产生的溴蒸气和氯气,故C正确;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗2.24L(标准状况)H2,根据电极反应:H2→2H++2e-,所以转移电子$\frac{2.24L}{22.4L/mol}$×2=0.02mol,a极的电极反应为:2Br--2e-→Br2,转移电子0.02mol,会产生0.01molBr2,Br2标准状况下为液态,故D错误.
故选C.
点评 本题考查学生原电池和电解池的工作原理,要求学生熟记教材知识,学以致用,难度不大.

练习册系列答案
相关题目
1.下列说法不正确的是( )
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 在油脂皂化反应实验中,用玻璃棒蘸取反应液滴入热水中,若无油滴浮于液面上,说明皂化反应已经完全 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化△t℃,反应液的比热容为c J•g-1•℃-1,则生成1mol水放出的热量为cm△t×10-3kJ | |
| D. | 同一温度下,可通过观察出现浑浊的快慢来探究浓度对Na2S2O3与稀硫酸反应速率的影响 |
10.国际组织无机化学命名委员会将长式周期表原先的主副族族号取消,由左向右按原结构编为18列,如碱金属为第1列,稀有气体为第18列.按这个规定,下列说法不正确的是( )
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第14列元素形成化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 第17、18列元素都是非金属元素 |
7.分子式为C5H10O2并能与NaOH溶液反应的有机构有(不含立体异构)( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
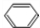 +HCHO+HCl$\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl$\stackrel{ZnCl_{2}}{→}$ +H2O.
+H2O.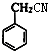 ;E的结构简式为
;E的结构简式为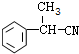 .
. .
.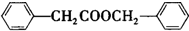 的合成路线
的合成路线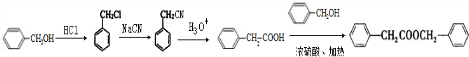 .
. 中和热的测定实验(如图).
中和热的测定实验(如图).

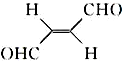 ,下列叙述正确的有AD.
,下列叙述正确的有AD.