题目内容
在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O反应中( )
| A、参加反应的硝酸和作氧化剂的硝酸质量比为2:1 |
| B、硝酸都用作氧化剂 |
| C、每个硝酸分子得到2个电子 |
| D、硝酸铜是氧化产物 |
考点:氧化还原反应
专题:
分析:该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+4价,部分N元素化合价不变,该反应中有一半的硝酸作氧化剂、部分硝酸体现酸性,据此分析解答.
解答:
解:该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+4价,部分N元素化合价不变,该反应中有一半的硝酸作氧化剂、一半体现酸性,
A.该反应中有一半的硝酸作氧化剂、一半体现酸性,所以参加反应的硝酸和作氧化剂的物质的量之比为2:1,根据m=nM知,摩尔质量相等,其质量之比等于物质的量之比,所以参加反应的硝酸和作氧化剂的硝酸质量比为2:1,故A正确;
B.该反应中有一半的硝酸作氧化剂、一半体现酸性,故B错误;
C.该反应中一半硝酸作氧化剂、一半体现酸性,所以并不是所有硝酸分子都得到1个电子,故C错误;
D.该反应中Cu失电子作还原剂,所以Cu(NO3)2是氧化产物,故D正确;
故选AD.
A.该反应中有一半的硝酸作氧化剂、一半体现酸性,所以参加反应的硝酸和作氧化剂的物质的量之比为2:1,根据m=nM知,摩尔质量相等,其质量之比等于物质的量之比,所以参加反应的硝酸和作氧化剂的硝酸质量比为2:1,故A正确;
B.该反应中有一半的硝酸作氧化剂、一半体现酸性,故B错误;
C.该反应中一半硝酸作氧化剂、一半体现酸性,所以并不是所有硝酸分子都得到1个电子,故C错误;
D.该反应中Cu失电子作还原剂,所以Cu(NO3)2是氧化产物,故D正确;
故选AD.
点评:本题考查氧化还原反应,侧重考查基本概念、基本理论,明确元素化合价变化是解本题关键,知道该反应中硝酸的作用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将0.2mol?L-1的偏铝酸钠溶液和0.4mol?L-1的盐酸等体积混合,混合液中离子浓度由大到小的顺序是( )
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )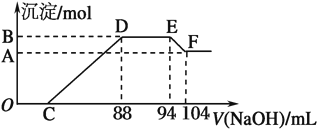

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
对下列实验的描述正确的是( )
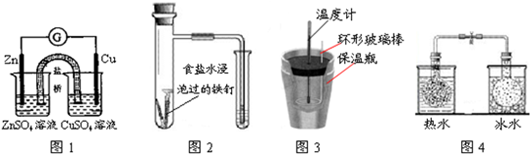

| A、图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 |
| B、图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C、图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
| D、图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是放热反应 |
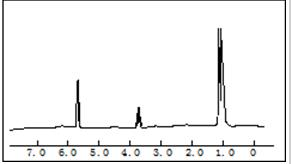 某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题: