题目内容
钠,镁,铝与产生氢气的物质的量之比分别为2:1,1:1,2:3.等物质的量的他们哪个产生的氢气最多的是 .
考点:化学方程式的有关计算
专题:计算题
分析:假设金属均为2mol,根据金属与氢气的物质的量之比计算氢气的物质的量,据此判断.
解答:
解:假设金属均为2mol,
钠与产生氢气的物质的量之比分别为2:1,则生成氢气为1mol;
镁与产生氢气的物质的量之比分别为1:1,则生成氢气为2mol;
铝与产生氢气的物质的量之比分别为2:3,则生成氢气为3mol,
故Al生成的氢气最多,
故答案为:Al.
钠与产生氢气的物质的量之比分别为2:1,则生成氢气为1mol;
镁与产生氢气的物质的量之比分别为1:1,则生成氢气为2mol;
铝与产生氢气的物质的量之比分别为2:3,则生成氢气为3mol,
故Al生成的氢气最多,
故答案为:Al.
点评:本题考查化学方程式有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在宁波奉化境内有一个“长寿村”,许多大都市的老年人到那里观光,还有人在那买房子.经科学研究表明是因为饮用水中有“硒”等矿物质,可以改善人体营养,增强体质.其中的“硒”是指( )
| A、分子 | B、原子 | C、离子 | D、元素 |
X、Y为两种短周期元素,Y的原子半径比X大.下列判断正确的是( )
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O反应中( )
| A、参加反应的硝酸和作氧化剂的硝酸质量比为2:1 |
| B、硝酸都用作氧化剂 |
| C、每个硝酸分子得到2个电子 |
| D、硝酸铜是氧化产物 |
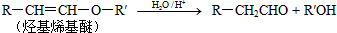

 .
.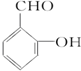 的属于芳香族化合物的两种官能团异构体的结构简式:
的属于芳香族化合物的两种官能团异构体的结构简式: )的一条路线如下
)的一条路线如下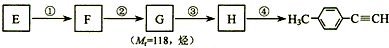
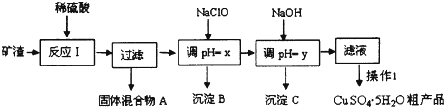
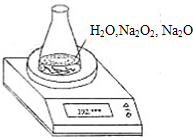 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.
 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题: