题目内容
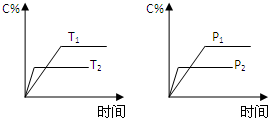 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:依据先拐先平数值大的原则,T2>T1,温度升高时,C的百分含量降低,说明升温平衡逆向移动,正反应放热,据此分析.
解答:
解:依据先拐先平数值大的原则,T2>T1,温度升高时,C的百分含量降低,说明升温平衡逆向移动,正反应放热,
A、正反应放热,升温平衡逆向移动,故A正确;
B、催化剂不影响平衡移动,故B错误;
C、无法判断反应物和生成物气体体积的大小,故C错误;
D、减小生成物浓度平衡逆向移动,故D错误;
故选A.
A、正反应放热,升温平衡逆向移动,故A正确;
B、催化剂不影响平衡移动,故B错误;
C、无法判断反应物和生成物气体体积的大小,故C错误;
D、减小生成物浓度平衡逆向移动,故D错误;
故选A.
点评:本题考查了温度对化学平衡的影响,注意先拐先平数值大,题目难度不大.

练习册系列答案
相关题目
下列溶液中有关物质的量浓度关系正确的是( )
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | ||
| B、已知0.1 mol?L-1 二元酸H2A溶液的pH=4,则在0.1 mol?L-1 Na2A溶液中:c(OH-)=c(HA-)+c(H+)+2c(H2A) | ||
| C、将0.1 mol?L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小 | ||
D、向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为( )
| A、减小、减小、增大 |
| B、减小、增大、增大 |
| C、增大、减小、减小 |
| D、减小、减小、减小 |
在恒温、体积为2L的密闭容器中进行反应:2A(g)
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
| 催化剂 |
| A、v(B)=0.03 mol?L-1?s-1 |
| B、v(C)=0.06 mol?L-1?s-1 |
| C、v(C)=0.03 mol?L-1?s-1 |
| D、v(B)=0.045 mol?L-1?s-1 |
反应2A(g)?2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A、加压 | B、减压 |
| C、减少E的浓度 | D、降温 |
反应A2(g)+3B2(g)?4C2(g)+2D2 (g) 在5L密闭容器中进行,半分钟后,C2的物质的量增加了0.3mol,则此反应的平均速率x( )
| A、(B2)=0.01mol?(L?s)-1 |
| B、(C2)=0.002mol?(L?s) -1 |
| C、(D2)=0.006mol?(L?s) -1 |
| D、(A2)=0.008mol?(L?s)-1 |
将反应Zn+Br2=ZnBr2设计成蓄电池,则下列有关说法不正确的是( )
| A、充电时,阳极的电极反应式为:2Br--2e-=Br2 |
| B、放电时,负极的电极反应式为:Zn-2e-=Zn2+ |
| C、放电时,Zn2+ 移向负极 |
| D、电解质溶液不可以用强碱,也不可以用强酸 |
2007年6月20日,新浪网报道了中国矿业大学发生的铊中毒事件.铊(Tl)在元素周期表中与铝处于同一主族,与铯(Cs)处于同一周期.下列有关说法正确的是( )
A、
| ||||
B、
| ||||
| C、Tl3+核外有6个电子层 | ||||
| D、Tl原子半径大于Cs原子半径 |
 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化: