题目内容
2007年6月20日,新浪网报道了中国矿业大学发生的铊中毒事件.铊(Tl)在元素周期表中与铝处于同一主族,与铯(Cs)处于同一周期.下列有关说法正确的是( )
A、
| ||||
B、
| ||||
| C、Tl3+核外有6个电子层 | ||||
| D、Tl原子半径大于Cs原子半径 |
考点:同一周期内元素性质的递变规律与原子结构的关系,同素异形体,质子数、中子数、核外电子数及其相互联系
专题:
分析:A.同素异形体是同种元素形成的不同单质;
B.根据中子数=质量数-质子数计算;
C.铊在周期表中位于第六周期;
D.根据同周期半径变化规律分析.
B.根据中子数=质量数-质子数计算;
C.铊在周期表中位于第六周期;
D.根据同周期半径变化规律分析.
解答:
解:A.同素异形体是同种元素形成的不同单质,所以201Tl与204Tl互为同位素,故A错误;
B.
Tl的中子数为122,20482Pb的中子数为122,所以二者中子数相同,故B正确;
C.铊在周期表中位于第六周期,原子核外有6个电子层,则Tl3+核外有5个电子层,故C错误;
D.Tl与铯(Cs)处于同一周期,而且Tl排在Cs的后面,所以Tl原子半径小于Cs原子半径,故D错误;
故选B.
B.
203 81 |
C.铊在周期表中位于第六周期,原子核外有6个电子层,则Tl3+核外有5个电子层,故C错误;
D.Tl与铯(Cs)处于同一周期,而且Tl排在Cs的后面,所以Tl原子半径小于Cs原子半径,故D错误;
故选B.
点评:本题考查了原子结构和元素的性质,熟悉元素在周期表中的位置及元素周期律是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-) |
| B、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后者 |
| C、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
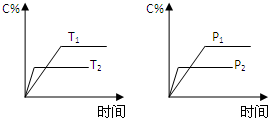 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
下列变化过程,属于放热反应的是( )
| A、液态水变成水蒸气 |
| B、酸碱中和反应 |
| C、浓H2SO4稀释 |
| D、弱酸的电离 |
25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
在该温度时,取2mol N2和7mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是( )
在该温度时,取2mol N2和7mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是( )
| A、92.4 kJ |
| B、92.4 kJ~184.8 kJ |
| C、小于184.8 kJ |
| D、184.8 kJ |
下列说法中正确的是( )
| A、非金属原子组成的化合物不可能是离子化合物 |
| B、ⅠA族元素的金属性一定比ⅡA族元素的金属性强 |
| C、同一主族元素组成的化合物一定是共价化合物 |
| D、NH4H中的所有原子的最外层都符合相应稀有气体原子电子层结构,1mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA |
| B、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| C、常温常压下,92g NO2和N2O4混合气体中含有的原子数为6NA |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA |