题目内容
反应2A(g)?2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
| A、加压 | B、减压 |
| C、减少E的浓度 | D、降温 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:达平衡时,要使v正降低,可采取降低温度、减小压强或减小浓度的措施,使c(A)增大,应使平衡向逆反应方向移动,据此结合外界条件对平衡移动影响分析.
解答:
解:A.增大压强,平衡向逆反应方向移动,A的浓度增大,正、逆反应速率都增大,故A错误;
B.降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B错误;
C.减少E的浓度,平衡向正反应方向移动,正、逆速率都减小,但A的浓度降低,故C错误;
D.降低温度,正、逆反应速率都减小,平衡向逆反应方向移动,A的浓度增大,故D正确.
故选D.
B.降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B错误;
C.减少E的浓度,平衡向正反应方向移动,正、逆速率都减小,但A的浓度降低,故C错误;
D.降低温度,正、逆反应速率都减小,平衡向逆反应方向移动,A的浓度增大,故D正确.
故选D.
点评:本题考查外界条件对化学平衡的影响,难度不大,本题注意根据反应方程式的特征判断平衡移动的方向.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
对于常温下pH为2的盐酸,叙述正确的是( )
| A、c(H+)=c(Cl-)+c(OH-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| D、与等体积0.01 mol?L-1乙酸钠溶液混合后溶液中:c(Cl-)=c(CH3COO-) |
在标准状况下,将1.12L由X、Y组成的混合气体用水全部吸收得到1L溶液,测得溶液的pH=1,则X、Y及其体积比可能是( )
| A、H2,Cl2; 1:1 |
| B、NO2,O2;4:1 |
| C、HCl,HBr;1:1 |
| D、Cl2,SO2;1:1 |
某温度时,水的Kw=1.0×10-12.则在该温度时,pH=7的溶液( )
| A、呈碱性 | B、呈中性 |
| C、呈酸性 | D、无法确定 |
在固定体积的容器内进行反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A、AB的消耗速率等于A2的消耗速率 |
| B、容器中各组分的浓度不随时间变化 |
| C、容器内气体的压强不再变化 |
| D、单位时间内生成n mol A2,同时生成n mol B |
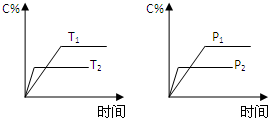 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
在该温度时,取2mol N2和7mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是( )
在该温度时,取2mol N2和7mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是( )
| A、92.4 kJ |
| B、92.4 kJ~184.8 kJ |
| C、小于184.8 kJ |
| D、184.8 kJ |
 (1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).