题目内容
反应A2(g)+3B2(g)?4C2(g)+2D2 (g) 在5L密闭容器中进行,半分钟后,C2的物质的量增加了0.3mol,则此反应的平均速率x( )
| A、(B2)=0.01mol?(L?s)-1 |
| B、(C2)=0.002mol?(L?s) -1 |
| C、(D2)=0.006mol?(L?s) -1 |
| D、(A2)=0.008mol?(L?s)-1 |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:利用v(C2)=
=
计算出C2的化学反应速率,再利用化学反应速率之比等于化学计量数之比来分析其他物质的反应速率,以此来解答.
| △c |
| △t |
| ||
| △t |
解答:
解:v(C2)=
=
=
=0.002mol?(L?s) -1,由化学反应速率之比等于化学计量数之比可知,
A.V(B2)=0.002mol?(L?s) -1×
=0.0015mol?(L?s) -1,故A错误;
B.v(C2)=0.002mol?(L?s) -1,故B正确;
C.V(D2)=0.002mol?(L?s) -1×
=0.001mol?(L?s) -1,故C错误;
D.V(D2)=0.002mol?(L?s) -1×
=0.0005mol?(L?s) -1,故D错误;
故选B.
| △c |
| △t |
| ||
| △t |
| ||
| 30s |
A.V(B2)=0.002mol?(L?s) -1×
| 3 |
| 4 |
B.v(C2)=0.002mol?(L?s) -1,故B正确;
C.V(D2)=0.002mol?(L?s) -1×
| 1 |
| 2 |
D.V(D2)=0.002mol?(L?s) -1×
| 1 |
| 4 |
故选B.
点评:本题考查化学反应速率的计算,明确其定义式及反应速率与化学计量数的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
常温下,下列各组数据中,前者比后者大的是( )
| A、浓度均为0.1mol?L-1的醋酸溶液和盐酸中的c(H+) |
| B、浓度均为0.1mol?L-1的(NH4)2SO4溶液和(NH4)2CO3溶液中的c(NH4+) |
| C、pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) |
| D、中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
在我国使用最早的合金是( )
| A、青铜 | B、白铜制品 |
| C、铁制品 | D、石块 |
 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是( )
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是( )| A、OA段没有发生任何反应 |
| B、C点的溶液的pH=7 |
| C、B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
| D、C点溶液中的溶质只有NaCl |
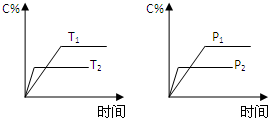 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的( )


| A、该电池不能在高温下工作 |
| B、电池的负极反应为:C6H12O6+6H2O+24e-=6CO2↑+24H+ |
| C、放电过程中,H+从正极区向负极区迁移 |
| D、在电池反应中,每通过0.2mol电子,理论上消耗1.12L氧气 |
下列变化过程,属于放热反应的是( )
| A、液态水变成水蒸气 |
| B、酸碱中和反应 |
| C、浓H2SO4稀释 |
| D、弱酸的电离 |
下列说法中正确的是( )
| A、非金属原子组成的化合物不可能是离子化合物 |
| B、ⅠA族元素的金属性一定比ⅡA族元素的金属性强 |
| C、同一主族元素组成的化合物一定是共价化合物 |
| D、NH4H中的所有原子的最外层都符合相应稀有气体原子电子层结构,1mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
