题目内容
向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为( )
| A、减小、减小、增大 |
| B、减小、增大、增大 |
| C、增大、减小、减小 |
| D、减小、减小、减小 |
考点:钠的重要化合物
专题:元素及其化合物
分析:一份加入少许冰醋酸,发生HAc+HCO3-=H2O+CO2↑+Ac-,一份加入少许Ca(OH)2固体,发生Ca2++2OH-+2HCO3-=2H2O+CaCO3↓+CO32-,一份加入少许NaA1O2固体,发生A1O2-+H2O+HCO3-=Al(OH)3↓+CO32-,以此来解答.
解答:
解:向三份0.lmol/L NaHCO3溶液中,
一份加入少许冰醋酸,发生HAc+HCO3-=H2O+CO2↑+Ac-,则溶液中c(CO32-)减小;
一份加入少许Ba(OH)2固体,发生Ba2++2OH-+2HCO3-=2H2O+BaCO3↓+CO32-,则溶液中c(CO32-)增大;
一份加入少许NaA1O2固体,发生A1O2-+H2O+HCO3-=Al(OH)3↓+CO32-,则溶液中c(CO32-)增大.
故选B.
一份加入少许冰醋酸,发生HAc+HCO3-=H2O+CO2↑+Ac-,则溶液中c(CO32-)减小;
一份加入少许Ba(OH)2固体,发生Ba2++2OH-+2HCO3-=2H2O+BaCO3↓+CO32-,则溶液中c(CO32-)增大;
一份加入少许NaA1O2固体,发生A1O2-+H2O+HCO3-=Al(OH)3↓+CO32-,则溶液中c(CO32-)增大.
故选B.
点评:本题考查溶液中的离子反应,明确发生的反应是分析离子浓度变化的关键,题目难度不大.

练习册系列答案
相关题目
下列关于酶的叙述中错误的是( )
| A、酶是一种具有催化作用大的蛋白质 |
| B、酶的催化作用具有专一性和高效性 |
| C、高温或重金属盐能降低酶的活性 |
| D、酶只有在强酸或强碱的条件下才能发挥作用 |
下列叙述正确的是( )
| A、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-) |
| B、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后者 |
| C、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
在标准状况下,将1.12L由X、Y组成的混合气体用水全部吸收得到1L溶液,测得溶液的pH=1,则X、Y及其体积比可能是( )
| A、H2,Cl2; 1:1 |
| B、NO2,O2;4:1 |
| C、HCl,HBr;1:1 |
| D、Cl2,SO2;1:1 |
在我国使用最早的合金是( )
| A、青铜 | B、白铜制品 |
| C、铁制品 | D、石块 |
某温度时,水的Kw=1.0×10-12.则在该温度时,pH=7的溶液( )
| A、呈碱性 | B、呈中性 |
| C、呈酸性 | D、无法确定 |
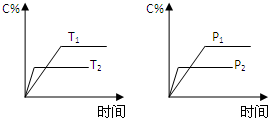 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA |
| B、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| C、常温常压下,92g NO2和N2O4混合气体中含有的原子数为6NA |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA |