题目内容
在恒温、体积为2L的密闭容器中进行反应:2A(g)
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速率为( )
| 催化剂 |
| A、v(B)=0.03 mol?L-1?s-1 |
| B、v(C)=0.06 mol?L-1?s-1 |
| C、v(C)=0.03 mol?L-1?s-1 |
| D、v(B)=0.045 mol?L-1?s-1 |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:根据v=
计算v(A),再利用不同物质表示的速率之比等于其化学计量数之比计算其它物质表示的速率.
| ||
| △t |
解答:
解:在2L的容器内,若A在前20s由3mol降为1.8mol,则前20s的平均反应速率v(A)=
=0.03 mol?L-1?s-1,不同物质表示的速率之比等于其化学计量数之比,则v(B)=
v(A)=
×0.03 mol?L-1?s-1=0.045 mol?L-1?s-1,v(C)=
v(A)=
×0.03 mol?L-1?s-1=0.015 mol?L-1?s-1,故ABC错误,D正确,故选D.
| ||
| 20s |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题化学反应速率,比较基础,处于定义法与化学计量数比值法,根据情况选择合适的计算方法,注意对速率规律的理解掌握.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
下列叙述正确的是( )
| A、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-) |
| B、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后者 |
| C、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
在我国使用最早的合金是( )
| A、青铜 | B、白铜制品 |
| C、铁制品 | D、石块 |
某温度时,水的Kw=1.0×10-12.则在该温度时,pH=7的溶液( )
| A、呈碱性 | B、呈中性 |
| C、呈酸性 | D、无法确定 |
 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是( )
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是( )| A、OA段没有发生任何反应 |
| B、C点的溶液的pH=7 |
| C、B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
| D、C点溶液中的溶质只有NaCl |
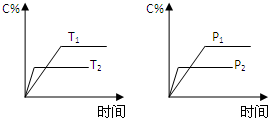 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
下列变化过程,属于放热反应的是( )
| A、液态水变成水蒸气 |
| B、酸碱中和反应 |
| C、浓H2SO4稀释 |
| D、弱酸的电离 |