题目内容
下列溶液中有关物质的量浓度关系正确的是( )
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | ||
| B、已知0.1 mol?L-1 二元酸H2A溶液的pH=4,则在0.1 mol?L-1 Na2A溶液中:c(OH-)=c(HA-)+c(H+)+2c(H2A) | ||
| C、将0.1 mol?L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小 | ||
D、向0.1 mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、设三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是c(NaOH)<c(Na2CO3)<c(CH3COONa);
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-)+2c(H2A);
C、稀释醋酸时,醋酸根离子、氢离子、醋酸分子浓度都减小,但氢氧根离子浓度增大;
D、溶液中铵根离子浓度增大,抑制了一水合氨的电离.
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-)+2c(H2A);
C、稀释醋酸时,醋酸根离子、氢离子、醋酸分子浓度都减小,但氢氧根离子浓度增大;
D、溶液中铵根离子浓度增大,抑制了一水合氨的电离.
解答:
解:A、设三种溶液的pH均为9,c(OH-)=10-5mol/L,c(NaOH)=10-5mol/L,但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3)>10-5mol/L,所以三种溶液的pH均为9,则物质的量浓度的大小顺序是c(NaOH)<c(Na2CO3)<c(CH3COONa),故A错误;
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-)+2c(H2A),故B正确;
C、稀释醋酸时,促进醋酸电离,醋酸根离子、氢离子的物质的量增大,醋酸分子的物质的量减小,但醋酸根离子、氢离子的物质的量增大程度小于溶液体积增大程度,所以醋酸根离子、氢离子、醋酸分子浓度都减小,但氢氧根离子浓度增大,故C错误;
D、向0.1mol/L的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则一水合氨的浓度增大,氢氧根离子的浓度减小,则溶液中
减小,故D错误;故选B.
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-)+2c(H2A),故B正确;
C、稀释醋酸时,促进醋酸电离,醋酸根离子、氢离子的物质的量增大,醋酸分子的物质的量减小,但醋酸根离子、氢离子的物质的量增大程度小于溶液体积增大程度,所以醋酸根离子、氢离子、醋酸分子浓度都减小,但氢氧根离子浓度增大,故C错误;
D、向0.1mol/L的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则一水合氨的浓度增大,氢氧根离子的浓度减小,则溶液中
| c(OH-) |
| c(NH3?H2O) |
点评:本题考查溶液中离子浓度大小判断,题目难度中等,注意明确溶液中离子浓度大小比较的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作正确的是( )
| A、中和滴定,锥形瓶用待测液润洗后再使用 |
| B、中和热的测定,读取混合溶液的最高温度为终止温度 |
| C、实验室制氯气,用饱和食盐水吸收尾气 |
| D、蔗糖的水解,在蔗糖溶液中加稀硫酸加热,再加入银氨溶液验证水解产物 |
下列关于酶的叙述中错误的是( )
| A、酶是一种具有催化作用大的蛋白质 |
| B、酶的催化作用具有专一性和高效性 |
| C、高温或重金属盐能降低酶的活性 |
| D、酶只有在强酸或强碱的条件下才能发挥作用 |
对于常温下pH为2的盐酸,叙述正确的是( )
| A、c(H+)=c(Cl-)+c(OH-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| D、与等体积0.01 mol?L-1乙酸钠溶液混合后溶液中:c(Cl-)=c(CH3COO-) |
常温下,下列各组数据中,前者比后者大的是( )
| A、浓度均为0.1mol?L-1的醋酸溶液和盐酸中的c(H+) |
| B、浓度均为0.1mol?L-1的(NH4)2SO4溶液和(NH4)2CO3溶液中的c(NH4+) |
| C、pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) |
| D、中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
下列叙述正确的是( )
| A、0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-) |
| B、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后者 |
| C、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
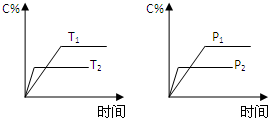 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |