题目内容
20.如图是常用的实验仪器(铁架台和玻璃导管、橡皮管、瓶塞等略去)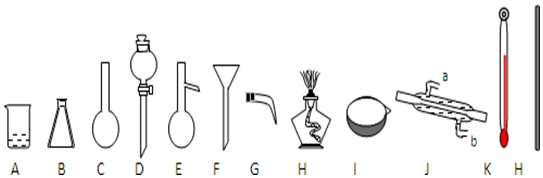
①填写以下仪器的名称:D分液漏斗,J冷凝管;
②用四氯化碳萃取溴水中Br2单质,萃取能否用酒精代替四氯化碳进行实验?否,解释其原因酒精与水互溶;
③蒸馏装置中,在E中加入沸石的目的是防止暴沸,仪器J的冷凝水应该b进a出( 填写a、b).
分析 ①由图可知仪器的名称;
②酒精与水互溶,不能作萃取剂;
③蒸馏装置中,在E中加入沸石防止液体剧烈沸腾,冷凝管中冷水下进上出,冷却效果好.
解答 解:①由图可知仪器D、J的名称分别为分液漏斗、冷凝管,故答案为:分液漏斗;冷凝管;
②萃取不能否用酒精代替四氯化碳进行实验,因酒精与水互溶,不能作萃取剂,故答案为:否;酒精与水互溶;
③蒸馏装置中,在E中加入沸石的目的是防止暴沸,冷凝管中冷水下进上出,冷却效果好,则仪器J的冷凝水应该b进a出,故答案为:防止暴沸;b; a.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用、混合物分离提纯实验为解答的关键,侧重分析与实验能力的考查,注意萃取、蒸馏的应用,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
11.向含有CO32-、HCO3-、SO32-、SO42-、NO3-、Cl-、Al3+、Na+、K+、Mg2+离子的某一溶液中加入一定量的过氧化钠固体,则浓度保持不变的离子是( )(溶液体积忽略不变)
| A. | CO32-、Na+、K+ | B. | SO42-、Cl-、K+ | C. | Cl-、NO3-、K+ | D. | HCO3-、SO42-、K+ |
8.下列叙述正确的是( )
| A. | 物质燃烧都是吸热反应 | B. | 化学反应总是伴随着能量的变化 | ||
| C. | 需要加热的反应一定是吸热反应 | D. | 化学反应中放出的热量就是反应热 |
15.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠与盐酸反应:CO3-+2H+═H2O+CO2↑ | |
| C. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
5.室温下,有下列四种溶液:①0.1mol.L-1氨水,②0.1mol•L-1 NH 4Cl溶液,③0.2mol•L-1 盐酸与0.2mol•L-1 NH4Cl溶液等体积混合,④0.2mol•L-1 NaOH溶液与0.2mol•L-1 氨水等体积混合,四种溶液中c(NH4+)由大到小排列正确的是( )
| A. | ②③④① | B. | ④①②③ | C. | ①④②③ | D. | ③②①④ |
12. 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)?CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为20500kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如表所示:
①T1>T2(填“>”、“=”或“<”);T1℃时,该反应的平衡常数K=12.8.
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是大于0.8mol/L,小于1.4mol/L.
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
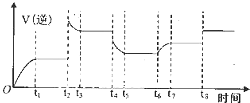
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,从t1到t8哪个时间段H2O(g)的平衡转化率最低t7-t8.
 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:方法①:C(s)+2H2O(g)?CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为20500kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是大于0.8mol/L,小于1.4mol/L.
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,从t1到t8哪个时间段H2O(g)的平衡转化率最低t7-t8.
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.