题目内容
12.150mL Fe2(SO4)3溶液中含Fe3+ 5.6g,溶液中SO42-的物质的量浓度是1mol/L.分析 根据n=$\frac{m}{M}$计算出5.6g铁离子的物质的量,再根据硫酸铁化学式计算出溶液中硫酸根离子的物质的量,再根据c=$\frac{n}{V}$计算出溶液中SO42-的物质的量浓度.
解答 解:n(Fe3+ )=$\frac{5.6g}{56g/mol}$=0.1mol,根据化学式可知Fe2(SO4)3得150mL该溶液中含有硫酸根离子的物质的量为0.1mol×$\frac{3}{2}$=0.15mol,
则溶液中SO42-的物质的量浓度为:c(SO42-)=$\frac{0.15mol}{0.15L}$=1mol/L,
故答案为:1mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
2.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L H2O中含有氢原子数目为2NA | |
| B. | 17 g NH3所含质子数为10NA | |
| C. | 0.1mol Cu(NO3)2中含有的离子数目为0.2NA | |
| D. | 28g N2 体积为22.4L |
7.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液与稀盐酸反应:H++OH-=H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+=2Na++H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
7.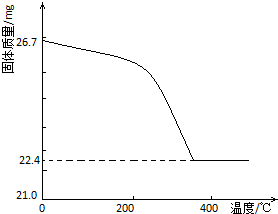 工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)上述反应的平衡常数表达式:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$.
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在Na2CO3溶液中PbSO4转化率较大,理由是相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大.
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:全部为2PbCO3•Pb(OH)2;
假设三:PbCO3与2PbCO3•Pb(OH)2的混合物.
(4)为验证假设一是否成立,课题组进行如下研究.
①定性研究:请你完成下表中内容.
②定量研究:取26.7mg的干燥样品,加热,测的固体质量随温度的变化关系如下图.某同学由图中信息得出结论:假设一不成立.你是否同意该同学的结论,并简述理由:同意若全部为PbCO3,26.7mg完全分解后,其固体质量为22.3mg.
 工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.(1)上述反应的平衡常数表达式:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$.
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在Na2CO3溶液中PbSO4转化率较大,理由是相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大.
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:全部为2PbCO3•Pb(OH)2;
假设三:PbCO3与2PbCO3•Pb(OH)2的混合物.
(4)为验证假设一是否成立,课题组进行如下研究.
①定性研究:请你完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,… |
5.下列溶液中,Cl-的物质的量浓度与50mL 1mol•L-1AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A. | 75mL 2mol•L-1FeCl3溶液 | B. | 25mL 2mol•L-1KCl溶液 | ||
| C. | 150mL 1mol•L-1NaCl溶液 | D. | 20mL 1.5mol•L-1 MgCl2溶液 |
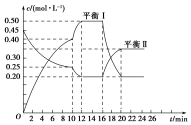 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示.请回答下列问题:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)?yC(g)△H<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示.请回答下列问题:
 回答下列问题:
回答下列问题: