题目内容
10. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.I.已知:NO2(g)+SO2(g)?SO3(g)+NO(g)
(1)一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是bc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO2和NO2的体积比保持不变
d.每消耗1mol SO3的同时生成1molNO2
e.气体密度保持不变
(2)若保持体积不变,升高温度,体系颜色加深,则说明该反应的△H<0(填”>””<”或”=”)
II.对于反应2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ/mol.
在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应.平衡时容器内气体压强为起始时的90%.此时
(3)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为98.3kJ.
(4)保持同一温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是2<a≤3.
(5)保持同一温度,在相同容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡不移动.(填“正向、不、逆向或无法确定是否”)
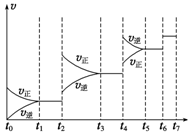
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是升高温度;图中表示平衡混合物中SO3的含量最高的一段时间是t3~t4.
(7)各阶段平衡时对应的平衡常数如表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
分析 (1)利用平衡的特征“等、定”及由此衍生的一些物理量来判断;
(2)升高温度,体系颜色加深,则说明平衡逆向移动,由此判断该反应的△H;
(3)根据压强之比等于物质的量之比计算平衡时混合气体总的物质的量,再利用差量法计算参加反应的二氧化硫的物质的量,结合热化学方程式计算放出的热量;
(4)根据(1)计算可知,原平衡时SO3的体积分数为$\frac{1mol}{4.5mol}$=$\frac{2}{9}$,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为$\frac{2}{9}$,则与原平衡为等效平衡,计算原平衡时二氧化硫的物质的量,欲使起始时反应表现为向正反应方向进行,则a应大于原平衡状态时二氧化硫的物质的量,结合极限法判断;
(5)假定体积为VL,利用三段式计算原平衡时各组分的物质的量,进而计算平衡常数,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,计算此时的浓度商,与平衡常数比较判断反应进行方向;
(6)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在反应向逆反应之前衡混合物中CO的含量最高;
(7)平衡常数只与温度有关,温度改变平衡常数改变,据此判断.
解答 解:(1)①a.由反应可知,三氧化硫是气体,反应前后气体的物质的量改变,体系压强始终保持不变,不能判定平衡状态,故a错误;
b.混合气体的颜色保持不变,即二氧化氮的浓度不变,达到平衡状态,故b正确;
c.SO2和NO2起始量不等,变化量相等,当SO2和NO2的体积比保持不变,可判断反应达到平衡,故c正确;
d.每生成1 mol SO3的同时消耗1mol NO2,只能判断正反应速率,不能确定正逆反应速率的关系,不能判定平衡状态,故d错误;
e.混合气体的质量和体积始终不变,密度始终是定值,不一定是平衡状态,故e错误;
故答案为:bc;
(2)升高温度,体系颜色加深,说明平衡逆向移动,则该反应的△H<0,故答案为:<;
(3)由题意气体压强为起使时的90%,则反应后总的物质的量为起使时的90%,平衡时总物质的量为(3mol+2mol)×90%=4.5mol,则平衡时各组成物质的量变化为:
2SO2+O2?2SO3 物质的量减少△n
2 1 2 1
1mol 0.5mol 1mol (3mol+2mol)-4.5mol=0.5mol
此时放出的热量为196.6KJ×$\frac{0.5mol}{1mol}$=98.3KJ,
故答案为:98.3kJ;
(4)原平衡时SO3的体积分数为$\frac{1mol}{4.5mol}$=$\frac{2}{9}$,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为$\frac{2}{9}$,则与原平衡为等效平衡,则a+c=3 b+0.5c=2,由(1)计算可知,平衡时二氧化硫的物质的量为3mol-1mol=2mol,欲使起始时反应表现为向正反应方向进行,则2<a≤3,
故答案为:2<a≤3;
(5)由题意气体压强为起使时的90%,则反应后总的物质的量为起使时的90%,平衡时总物质的量为(3mol+2mol)×90%=4.5mol,则平衡时各组成物质的量变化为:
2SO2+O2?2SO3
开始(mol):3 2 0
变化(mol):1 0.5 1
平衡(mol):2 1.5 1
假定体积为VL,则k=$\frac{(\frac{1}{V})^{2}}{(\frac{2}{V})^{2}×\frac{1.5}{V}}=\frac{V}{6}$,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,此时的浓度商Qc=$\frac{(\frac{3}{V})^{2}}{(\frac{3}{V})^{2}×\frac{6}{V}}=\frac{V}{6}$,等于平衡常数,处于平衡状态,平衡不移动,
故答案为:不;
(6)t4时正逆反应速率都较原平衡时的速率大,反应向逆反应方向移动,升高温度;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,
故答案为:升高温度;t3~t4;
(7)由图象分析可知,t1~t2与t3~t4温度相同,t5~t6与t7~t8温度相同,且t4后升高温度,平衡逆向移动,平衡常数逆向移动,则k1=k2>k3=k4,
故答案为:k1=k2>k3=k4.
点评 考查反应热的计算、平衡状态的判断、化学平衡影响因素和平衡计算的分析判断,(5)中反应进行方向判断为易错点、难点,综合性较强,掌握基础是关键,题目难度中等.

(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
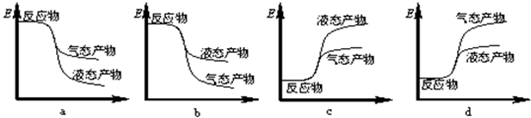
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.下列表示该反应的能量变化的示意图中正确的是a(填字母代号).
②合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH2OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)甲醇在原电池上的使用,提高了燃料的利用效率,达到节能减排的目的.若用熔融的Na2CO3使作电解质、氧气作助燃剂组成的燃料电池,写出负极的电极反应式:2CH3OH-12e-+6CO32-=8CO2+4H2O.
 CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系.
X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-) | |
| B. | 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| A. | 标准状况下,22.4 L H2O中含有氢原子数目为2NA | |
| B. | 17 g NH3所含质子数为10NA | |
| C. | 0.1mol Cu(NO3)2中含有的离子数目为0.2NA | |
| D. | 28g N2 体积为22.4L |
| A. | 用苯萃取溴水中的溴 | B. | 氯气溶于水 | ||
| C. | 石油的蒸馏 | D. | 食盐溶于水 |
 一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.
一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.