题目内容
12. 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:方法①:C(s)+2H2O(g)?CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为20500kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是大于0.8mol/L,小于1.4mol/L.
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
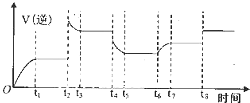
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,从t1到t8哪个时间段H2O(g)的平衡转化率最低t7-t8.
分析 (1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
根据盖斯定律,①-$\frac{1}{2}$×②-$\frac{1}{2}$×③可得CO(g)+H2O(g)?CO2(g)+H2(g)的△H,进而计算制备1000gH2所放出的能量;
(2)①由热化学方程式:①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
根据盖斯定律,①-②可得:C(s)+2H2O(g)?CO2(g)+2H2(g)△H=+90kJ•mol-1,
甲、乙中起始水蒸气的浓度相等,若温度相同时平衡时氢气的浓度相等,而甲中平衡时氢气浓度大于乙中的,可以判断甲相当于在乙平衡的基础上改变温度使平衡正向移动;
计算平衡时各组分物质的量浓度,代入K=$\frac{c(C{O}_{2})×{c}^{2}({H}_{2})}{{c}^{2}({H}_{2}O)}$计算平衡常数;
②前1.5min时氢气物质的量减小量小于平衡时的减小量,而前1.5min的反应速率大于后1.5min的反应速率;
③可逆反应得到平衡时,同种物质的正、逆反应速率相等(不同物质的正、逆速率之比等于其化学计量数之比),各组分的含量、浓度保持不变,判断平衡的物理量由变化到不再变化,说明反应到达平衡;
④t2时刻,瞬间v逆增大,而后减小至不变,平衡逆向移动,可能是增大压强(或者增大生成物的浓度);
t4时刻,瞬间v逆减小,而后继续减小至不变,平衡逆向移动,应是降低温度;
t6时刻,瞬间v逆不变,而后增大至不变,平衡正向移动,可能增大水蒸气浓度;
t8时刻,瞬间v逆增大,平衡不移动,应是使用催化剂.
解答 解:(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
根据盖斯定律,①-$\frac{1}{2}$×②-$\frac{1}{2}$×③可得CO(g)+H2O(g)?CO2(g)+H2(g)△H=-394kJ•mol-1-$\frac{1}{2}$×(-222kJ•mol-1)-$\frac{1}{2}$×(-484kJ•mol-1)=-41kJ•mol-1,
则制备1000gH2所放出的能量为$\frac{1000g}{2g/mol}$×41kJ•mol-1=20500kJ,
故答案为:20500;
(2)①由热化学方程式:①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
根据盖斯定律,①-②可得:C(s)+2H2O(g)?CO2(g)+2H2(g)△H=90kJ•mol-1,
甲、乙中起始水蒸气的浓度相等,若温度相同时平衡时氢气的浓度相等,而甲中平衡时氢气浓度大于乙中的,可以判断甲相当于在乙平衡的基础上改变温度使平衡正向移动,该反应的正反应是吸热反应,升高温度平衡正向移动,所以温度T1>T2;
C(s)+2H2O(g)?CO2(g)+2H2(g)
开始(mol/L)2 0 0
反应(mol/L)1.6 0.8 1.6
平衡(mol/L)0.4 0.8 1.6
K=$\frac{c(C{O}_{2})×{c}^{2}({H}_{2})}{{c}^{2}({H}_{2}O)}$=$\frac{0.8×1.{6}^{2}}{0.{4}^{2}}$=12.8,
故答案为:>;12.8;
②前1.5min时氢气物质的量减小量小于平衡时的减小量,1.5min时氢气的物质的量大于2mol-1.2mol=0.8mol,即1.5min时氢气浓度大于0.8mol/L,前1.5min的反应速率大于后1.5min的反应速率,前1.5min氢气的减少量应大于1.2mol÷2=0.6mol,所以氢气的物质的量应该小于2mol-0.6mol=1.4mol,即浓度小于1.4mol/L,
故答案为:大于0.8mol/L,小于1.4mol/L;
③A.2V逆(CO2)=V正(H2)时反应达到平衡状态,所以V逆(CO2)=2V正(H2)该反应没有达到平衡状态,故错误;
B.反应前后气体质量增加、容器体积不变,则反应前后混合气体的密度增大,当容器内气体密度不变时正逆反应速率相等,反应达到平衡状态,故正确;
C.c(H2O):c(CO2):c(H2)=2:1:2时该反应不一定达到平衡状态,与反应物初始浓度及转化率有关,故错误;
D.反应前后气体质量增加、气体物质的量增加,所以混合气体平均摩尔质量改变,当混合气体的平均摩尔质量保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
④t4时刻,瞬间v逆减小,而后继续减小至不变,平衡逆向移动,应是降低温度;
t6时刻,瞬间v逆不变,而后增大至不变,平衡正向移动,可能增大水蒸气浓度;
t8时刻,瞬间v逆增大,平衡不移动,应是使用催化剂;
t2时刻,瞬间v逆增大,而后减小至不变,平衡逆向移动,可能是增大压强(或者增大生成物的浓度),所以t6时刻改变的条件是通入H2O,从t1到t8时间段H2O(g)的平衡转化率最低的是平衡逆向移动最大时,为 t7-t8,
故答案为:通入H2O; t7-t8.
点评 本题考查化学平衡计算、外界条件对化学平衡移动影响、盖斯定律等知识点,侧重考查学生分析、判断及计算能力,明确化学平衡状态判断依据、化学平衡计算方法是解本题关键,难点是(2)①中等效平衡的建立,题目难点中等.

| A. | 用苯萃取溴水中的溴 | B. | 氯气溶于水 | ||
| C. | 石油的蒸馏 | D. | 食盐溶于水 |
 工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.(1)上述反应的平衡常数表达式:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$.
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在Na2CO3溶液中PbSO4转化率较大,理由是相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大.
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3•Pb(OH)2],它和PbCO3受热都易分解生成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:全部为2PbCO3•Pb(OH)2;
假设三:PbCO3与2PbCO3•Pb(OH)2的混合物.
(4)为验证假设一是否成立,课题组进行如下研究.
①定性研究:请你完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,… |
| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
 回答下列问题:
回答下列问题: