题目内容
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 ;
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①H3PO2中,P元素的化合价为 ;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式);
③NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性”、“中性”或“弱碱性”);
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式 ;
(4)H3PO2也可用电渗析法制备.“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式 ;
②分析产品室可得到H3PO2的原因 ;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有 杂质,该杂质产生的原因是 .
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
③NaH2PO2为
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式
(4)H3PO2也可用电渗析法制备.“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有
考点:真题集萃,氧化还原反应,电解质在水溶液中的电离,电解原理,磷
专题:电化学专题,元素及其化合物
分析:(1)根据H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;
(2)①根据化合物中总化合价为0计算出P元素的化合价;
②先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为4:1计算出反应产物中P的化合价;
③根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐,由于为H3PO2为弱电解质,则NaH2PO2为强碱弱酸盐,则溶液显示弱碱性;
(3)根据题干信息“将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2”写出该反应的化学方程式为;
(4)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因;
③根据H3PO2及NaH2PO2均容易被氧化分析该装置缺点.
(2)①根据化合物中总化合价为0计算出P元素的化合价;
②先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为4:1计算出反应产物中P的化合价;
③根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐,由于为H3PO2为弱电解质,则NaH2PO2为强碱弱酸盐,则溶液显示弱碱性;
(3)根据题干信息“将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2”写出该反应的化学方程式为;
(4)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因;
③根据H3PO2及NaH2PO2均容易被氧化分析该装置缺点.
解答:
解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为:H3PO2?H2PO2-+H+,
故答案为:H3PO2?H2PO2-+H+;
(2)①H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为:+1价,
故答案为:+1;
②该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,
故答案为:H3PO4;
③由于H3PO2是一元中强酸,所以NaH2PO2为正盐,由于为H3PO2为弱电解质,则NaH2PO2为强碱弱酸盐,溶液显示弱碱性,
故答案为:正;弱碱性;
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,该反应的化学方程式为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑;
(4)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,
故答案为:2H2O-4e-=O2↑+4H+;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,
故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-,
故答案为:PO43-;H2PO2-或H3PO2被氧化.
故答案为:H3PO2?H2PO2-+H+;
(2)①H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为:+1价,
故答案为:+1;
②该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,
故答案为:H3PO4;
③由于H3PO2是一元中强酸,所以NaH2PO2为正盐,由于为H3PO2为弱电解质,则NaH2PO2为强碱弱酸盐,溶液显示弱碱性,
故答案为:正;弱碱性;
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,该反应的化学方程式为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑;
(4)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O-4e-=O2↑+4H+,
故答案为:2H2O-4e-=O2↑+4H+;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,
故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-,
故答案为:PO43-;H2PO2-或H3PO2被氧化.
点评:本题考查了盐的水解原理、电解原理、弱电解质的电离、氧化还原反应等知识,题目难度较大,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
相关题目
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法正确的是( )
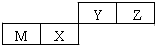
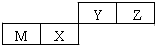
| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的小 |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
已知:
C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A、△H1>0,△H3<0 |
| B、△H2>0,△H4>0 |
| C、△H1=△H2+△H3 |
| D、△H3=△H4+△H5 |
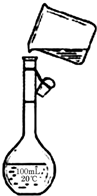 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
 (一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
(一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表: