题目内容
3.在理论上不能用于设计原电池的化学反应是( )| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
分析 自发的放热的氧化还原反应能设计成原电池,以此来解答.
解答 解:A、属于复分解反应,不是氧化还原反应,不能用于设计原电池,故A正确;
B、属于自发的氧化还原反应,能设计成原电池,故B错误;
C、属于自发的氧化还原反应,能设计成原电池,故C错误;
D、属于自发的氧化还原反应,能设计成原电池,故D错误.
故选A.
点评 本题考查了氧化还原反应和原电池原理,题目难度不大,注意把握原电池的构成条件,明确能自动发生的氧化还原反应能设计成原电池是解答本题的关键.

练习册系列答案
相关题目
13.下列反应的离子方程式书写正确的是( )
| A. | 偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 石灰水中加入少量小苏打:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-=Cu(OH)2↓ |
14.下列关于化学键的说法,正确的是( )
| A. | 化合物中一定没有非极性键 | |
| B. | 单质中不可能含有离子键 | |
| C. | 金属元素与非金属元素间形成的键均是离子键 | |
| D. | CO2、CH4分子中每个原子最外层均形成了8电子结构 |
11.“封管实验”具有简易、方便、节约、绿色等优点,观察下列四幅图(夹持装置未画出),判断下列说法正确的是( )
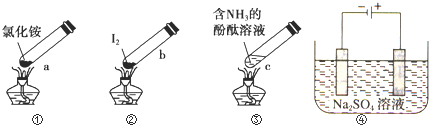

| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
18.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1KJ/mol
(1)在一定温度下,向体积为2L的密闭容器中充入0.40molCH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如表所示:
①计算该反应第一次达平衡时的平衡常数计算式K=$\frac{0.1×0.{3}^{3}}{0.1×0.2}$
②3min时改变的反应条件可能是升高温度、或增大H2O(g)的浓度、或减小CO的浓度 (只填一种条件的改变即可).
(2)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示.
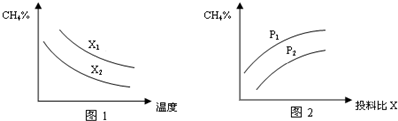
①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(3)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有的 KOH溶液,在反应后恰好生成KHCO3溶液,则该溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)在一定温度下,向体积为2L的密闭容器中充入0.40molCH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如表所示:
| 时间 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
②3min时改变的反应条件可能是升高温度、或增大H2O(g)的浓度、或减小CO的浓度 (只填一种条件的改变即可).
(2)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示.

①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(3)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有的 KOH溶液,在反应后恰好生成KHCO3溶液,则该溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
8.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知(1)a、d、e均能与稀盐酸反应产生氢气;(2)b能从c的盐溶液中置换出c单质;(3)a与强碱溶液反应放出气体;(4)a、e在冷浓硝酸或浓硫酸中发生钝化.由此可判断a、b、c、d、e依次是( )
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
13.短周期主族元素X、Y、Z、W在周期表中的相对位置如表,四种元素的原子最外层电子数之和为20.下列说法正确的是( )
| X | Y | Z |
| W |
| A. | W位于第三周期ⅥA族 | |
| B. | 元素最高正价:Z>Y>X | |
| C. | 简单气态氢化物稳定性:W>Y>X | |
| D. | 工业上催化氧化Y的氢化物可用于制备其含氧酸 |


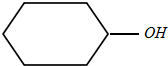 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )