题目内容
19.某小组同学用如图所示装置研究电化学原理.下列关于该原电池的说法不正确的是( )
| A. | 原电池的总反应为Fe+Cu2+═Fe2++Cu | |
| B. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-═H2↑ | |
| D. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子 |
分析 该原电池中Fe作负极,负极反应为Fe-2e-═Fe2+,C作正极,正极上是溶液中的阳离子得电子,则正极反应为Cu2++2e-=Cu,溶液中阴离子向负极移动,结合电子转移计算.
解答 解:A、负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-=Cu,则原电池的总反应为Fe+Cu2+═Fe2++Cu,故A正确;
B、盐桥中是KNO3溶液,则盐桥中NO3-移向负极移动,即向甲烧杯,故B错误;
C、其他条件不变,若将CuCl2溶液换为NH4Cl溶液,溶液中的氢离子在正极上得电子,则石墨电极反应式为2H++2e-═H2↑,故C正确;
D、Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
解得:n=0.2mol,故D正确.
故选:B.
点评 本题考查了原电池原理的分析应用,把握电极反应和电极判断、电子守恒的计算应用是解题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
10.用1L1.0mol/LNaOH溶液吸收0.8molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
| A. | 2:3 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
14.下列关于化学键的说法,正确的是( )
| A. | 化合物中一定没有非极性键 | |
| B. | 单质中不可能含有离子键 | |
| C. | 金属元素与非金属元素间形成的键均是离子键 | |
| D. | CO2、CH4分子中每个原子最外层均形成了8电子结构 |
11.“封管实验”具有简易、方便、节约、绿色等优点,观察下列四幅图(夹持装置未画出),判断下列说法正确的是( )
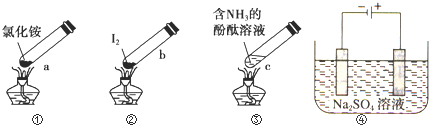

| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
8.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知(1)a、d、e均能与稀盐酸反应产生氢气;(2)b能从c的盐溶液中置换出c单质;(3)a与强碱溶液反应放出气体;(4)a、e在冷浓硝酸或浓硫酸中发生钝化.由此可判断a、b、c、d、e依次是( )
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
9.将m g的某种可燃物A在过量的氧气中充分燃烧,再将燃烧的产物通过足量Na2O2充分地吸收,发现固体增加的质量大于m g.则可燃物A可能是( )
| A. | 一氧化碳 | B. | 乙醇(C2H5OH) | C. | 甲酸(HCOOH) | D. | 甲醇(CH3OH) |
 .如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.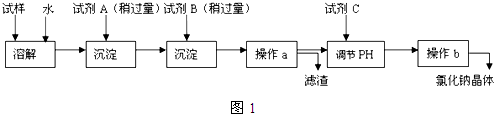
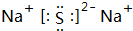 .
.