题目内容
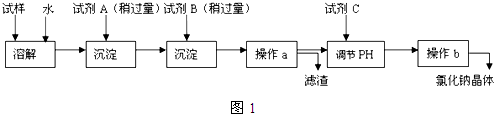
17.某工业废水含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理拟用下列流程进行处理:
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为CN-+ClO-═CNO-+Cl-.
(2)步骤③的反应方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-,反应中S2O32-失去e-2.4mo1.
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去.
(4)在25℃下,将a mol•L-1的NaCN溶液与0.01mol•L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示CN-的水解常数Kh=(100a-1)×10-7mol•L-1.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是(填字母).
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
C.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用Cr2O72-通过下列方法测定某锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnCl2中加入过量的FeCl3溶液,用b mol/L K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m mL.则锡粉中锡的质量分数是$\frac{3mbM}{1000a}$.(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
分析 (1)步骤②中,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,结合电荷守恒和原子守恒书写离子方程式;
(2)根据0.4 mol Cr2O72-等转化为Cr3+即可计算出转移电子的物质的量;
(3)加入熟石灰进一步处理,调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka﹦(100a-1)×10-7 mol•L-1;
a、溶液中存在电荷守恒,阴阳离子电荷总数相同,电性相反;
b、溶液中存在物料守恒,浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,溶液中钠离子物质的量的2倍等于HCN和CN-物质的量总和;
c、混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,水解促进水的电离;
d、溶液混合后形成的是缓冲溶液,加入少量酸或碱,溶液酸碱性变化不大;
(5)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,据此计算.
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4molCr2O72-共得到了0.4×(2×3)mol=2.4mol;
故答案为:2.4;
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去;
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,故氰化钠应该多些,故a>0.01; 根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),PH=7,c(H+)=c(OH-),c(CN-)=c(Na+)-c(Cl-)=$\frac{a}{2}$mol/L-$\frac{0.01}{2}$mol/L;
再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=$\frac{a}{2}$mol/L;Ka﹦$\frac{c({H}^{+})c(C{N}^{-})}{c(HCN)}$=$\frac{(\frac{a}{2}-\frac{0.01}{2})×1{0}^{-7}}{\frac{0.01}{2}}$=(100a-1)×10-7 mol•L-1;
若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度;
a、据电荷守恒可知c(H+)+c(Na+)=c(CN-)+c(OH-),此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-),故a正确;
b.由物料守恒可知c(HCN)+c(CN-)=0.1mol•L-1,所以c(HCN)+c(CN-)=2c(Na+),故b错误;
c.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后,混合后得溶液中c(HCN)=0.05 mol•L-1,c(NaCN)=0.05 mol•L-1,溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,混合溶液中水的电离程度一定大于该温度下纯水的电离程度,故c正确;
d.若25℃时将浓度均为0.1mol•L-1的NaCN、HCN溶液等体积混合后形成缓冲溶液,此溶液加入少量氢氧化钠抑制水解,促进电离,加入盐酸抑制电离促进水解,溶液酸碱性变化不大,所以溶液的pH变化不大,故d正确;
故答案为:(100a-1)×10-7 mol•L-1 ;b;
(5)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7
Mg $\frac{1}{3}$ mol
a×x bmol/L×$\frac{m}{1000}$L
解得x=$\frac{3mbM}{1000a}$,
故答案为:$\frac{3mbM}{1000a}$.
点评 本题以工艺流程为载体,侧重化学基本概念、基本理论,考查了氧化还原反应及离子方程式的书写,水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识.考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
 利用如图1装置测定中和热的实验步骤如下:
利用如图1装置测定中和热的实验步骤如下:①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)仪器A的名称为环形玻璃搅拌棒.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)$\frac{1}{2}$H2SO4(l)+NaOH(l)=$\frac{1}{2}$Na2SO4(l)+H2O(l)△H=-57.3KJ/mol.
(3)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)D.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为1.5 mol•L-1.
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A. | 实验①中铁钉只做还原剂 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
| A. | 一氧化碳 | B. | 乙醇(C2H5OH) | C. | 甲酸(HCOOH) | D. | 甲醇(CH3OH) |
| A. | 1:3 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
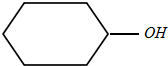 ),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )
),丙酮(CH3COCH3)和乙醛混合物1.75g,完全燃烧后,所得气体通过P2O5吸收瓶,瓶增重1.8g,则混合物的平均相对分子质量为( )