题目内容
6.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)称取粗盐$→_{①}^{溶解}$$→_{②}^{BaCl_{2}}$
 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐称取粗盐滤液精盐 称取粗盐①②③④⑤⑥⑦蒸发、结晶、烘干 溶解 BaCl2 Na2CO3NaOH适量盐酸
(1)判断BaCl2已过量的方法
(1)判断BaCl2已过量的方法是取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可).
(2)第④步中,写出相应的离子方程式:Ca2++CO32-=CaCO3↓; Ba2++CO32-=BaCO3↓;
(3)在
 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.(4)从实验设计方案优化的角度分析步骤②和④可否颠倒否(填“是”或“否”,如果“否”,请说明理由.)原因是:过量的BaCl2必须要用Na2CO3除去,步骤复杂;步骤③和④可否颠倒是.
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:会有部分沉淀溶解,从而影响制得精盐的纯度.
分析 由流程可知,①溶解,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,⑤过滤,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶⑦烘干得到NaCl.
(1)钡离子除去硫酸根离子,钡离子过量,再加氯化钡不会生成沉淀;
(2)加入过量的Na2CO3去除钙离子的多余的钡离子,形成碳酸钡、碳酸钙沉淀;
(3)③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,得到氢氧化镁、碳酸钙、碳酸钡沉淀,通过⑤过滤,达到固液分离;
(4)除去钙离子用碳酸钠、除去镁离子用氢氧化钠、除去硫酸根离子用氯化钡,过滤后用盐酸除去过量的氢氧根离子、碳酸根离子,碳酸钠必须放在氯化钡溶液之后,据此判断;
(5)碳酸钡、碳酸钙、氢氧化镁溶于盐酸,先用盐酸再进行操作⑤,影响制得精盐的纯度.
解答 解:(1)BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可),
故答案为:取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可);
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的实质是:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(3)由流程可知,①溶解,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子Mg2++2OH-=Mg(OH)2↓,④中加碳酸钠可除去钡离子、钙离子,⑤过滤,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶⑦烘干得到NaCl,
故答案为:NaOH ⑤过滤;
(4)除去粗盐中的可溶性杂质:Ca2+、Mg2+、SO42-时,可以加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓,最后加适量盐酸,盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;碳酸钠必须加在氯化钡之后,否则过量的钡离子无法除去,所以步骤②和④不可以颠倒,至于先除镁离子、还是先除钙离子,无先后,所以步骤③和④可颠倒,
故答案为:否;过量的BaCl2必须要用Na2CO3除去,步骤复杂; 是;
(5)⑤过滤除掉碳酸钡、碳酸钙、氢氧化镁、硫酸钡沉淀,过滤后主要为氯化钠和碳酸钠,若先用盐酸再进行操作⑤,碳酸钡、碳酸钙、氢氧化镁溶于盐酸,从而影响制得精盐的纯度,
故答案为:会有部分沉淀溶解,从而影响制得精盐的纯度.
点评 本题主要考查了粗盐提纯实验,为高频考查点,侧重于学生的分析和实验能力的考查,综合性强,要注意除杂质选取和添加的先后顺序,注意相关基础知识的积累,题目难度中等.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 25℃,1标准大气压下,64g SO2 中含有的原子数为3NA | |
| D. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
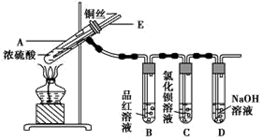
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
反应原理:
相关资料:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
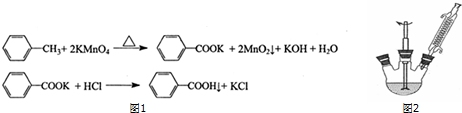
①如图2组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/mL).
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)仪器 a名称为(蛇形)冷凝管.
(2)判断甲苯己完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52mL.V3=23.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为90%.
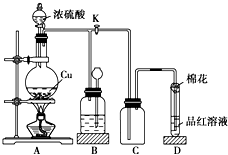 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答: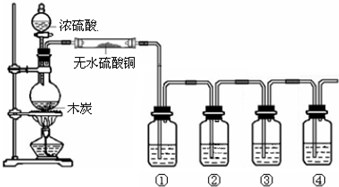
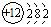 ,O2-结构示意图:
,O2-结构示意图: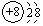 .
.