题目内容
16.按要求完成下列填空:(1)画出Mg原子结构示意图:
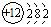 ,O2-结构示意图:
,O2-结构示意图: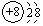 .
.(2)现有以下物质:①NaCl溶液;②Cu;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰.
其中:属于电解质的是④⑤;属于非电解质的是③⑥;能导电的是①②④(以上都用序号填写).
(3)11.0g 由${\;}_1^2H$和${\;}_8^{18}O$组成的水分子,其中含中子数为6mol,电子数为5mol.
(4)已知某植物营养液配方为0.3mol KCl,0.2mol K2SO4,0.1mol ZnSO4和1L水.若以KCl,K2SO4,ZnCl2和1L水为原料配得相同组成的营养液,需三种溶质KCl0.1 mol,K2SO40.3 mol,ZnCl20.1 mol.
分析 (1)镁原子核外12个电子,分为三个电子层最外层为2个电子,氧离子是氧原子得到2个电子形成的阴离子,核外两个电子层最外层8个电子;
(2)电解质是在水溶液中或在熔融状态下就能够导电(自身电离成阳离子与阴离子)的化合物,例如酸、碱和盐等;在水溶液中和在熔融状态下都不能导电的化合物叫非电解质;物质导电的条件是含有自由电子或者自由移动的离子;
(3)根据n=$\frac{m}{M}$计算水的物质的量,结合分子含有含有中子数、电子数计算中子、电子的物质的量,再根据N=nNA计算电子数目;
(4)以KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的营养液,要计算所需KCl、K2SO4、ZnCl2物质的量,应从离子的物质的量的相等的角度进行计算.
解答 解:(1)镁原子核外12个电子,分为三个电子层最外层为2个电子,Mg原子结构示意图: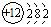 ,氧离子是氧原子得到2个电子形成的阴离子,核外两个电子层最外层8个电子O2-结构示意图:
,氧离子是氧原子得到2个电子形成的阴离子,核外两个电子层最外层8个电子O2-结构示意图: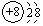 ,
,
故答案为: ;
; ;
;
(2)①NaCl溶液含有自由离子,能够导电;属于混合物,既不是电解质也不是非电解质;
②Cu含有自由电子,能够导电;是单质,既不是电解质也不是非电解质;
③乙醇(C2H5OH)不含有自由电子或者自由移动的离子,不导电;在水溶液中和在熔融状态下都能导电,属于电解质;
④熔融的KNO3含有自由移动的离子,能导电;在水溶液中和在熔融状态下能导电,属于电解质;
⑤BaSO4固体不含有自由电子或者自由移动的离子,不导电;在熔融状态下能导电,属于电解质;
⑥干冰不含有自由电子或者自由移动的离子,不导电;本身不能电离产生自由移动离子,属于非电解质;
属于电解质的为④⑤,属于非电解质的为③⑥,能导电的为①②④;
故答案为:④⑤、③⑥、①②④;
(3)由21H和188O组成的水分子的相对分子质量为22,则11g的物质的量为$\frac{11g}{22g/mol}$=0.5mol,其中含中子数为(2×1+18-8)×0.5mol=6mol,电子数为(2×1+8)×0.5mol=5mol,
故答案为:6;5;
(4)解:0.3molKCl、0.2molK2SO4、0.1molZnSO4中,含有的各离子的物质的量为:
n(K+)=0.3mol+0.2mol×2=0.7mol,
n(Zn2+)=0.1mol,
n(Cl-)=0.3mol,
n(SO42-)=0.2mol+0.1mol=0.3mol,
所以需要需n(K2SO4)=0.3mol;
n(ZnCl2)=0.1mol;
n(KCl)=0.7mol-2×0.3mol=0.1mol,
根据锌离子守恒可知,需要n(ZnCl2)=0.1mol,此时也提供了Cl-0.2mol,再由SO42-守恒得n(K2SO4)=0.3mol,由Cl-守恒,则n(KCl)=0.3mol-0.2mol=0.1mol,
所以KCl、K2SO4、ZnCl2的物质的量各是0.1mol、0.3mol、0.1mol,
故答案为:0.1,0.3,0.1.
点评 本题考查了原子结构、电解质与非电解质的判断、物质的量的计算以及原子结构,熟悉电解质、非电解质概念是解题关键,注意单质、混合物既不是电解质,也不是非电解质,题目难度不大.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
已知Cu2+、Fe3+和Fe2+的氢氧化物开始和完全沉淀时的pH,见表.请回答:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
(2)最适合作氧化剂X的是C(填序号).
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
在酸性条件下,氧化剂X与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2 H2O.
(3)加入的物质Y以调节溶液pH,Y的化学式是CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,pH的范围是调节溶液的pH至3.2~4.7.
(4)只能在HCl气流中加热浓缩才能得到CuCl2•2H2O晶体,HCl气流起的作用是:防止加热过程中CuCl2发生水解生成Cu (OH)2.
(5)已知Ksp(ZnS)>Ksp(CuS).地表层原生铜的硫化物经氧化、水浸作用后变成CuSO4溶液,再向地下深层渗透,遇到难溶的ZnS慢慢转变为铜蓝(CuS).用离子方程式解释ZnS能转变为CuS的原因Cu2+(aq)+ZnS(s)═Zn2+(aq)+CuS(s).
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
 在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )
在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )| A. | 正反应放热,L是气体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L不是气体 | D. | 正反应吸热,L不是气体 |
 如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )
如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )| A. | D中可以盛放浓硫酸 | B. | D中可以盛放饱和食盐水 | ||
| C. | D中可以盛放水 | D. | A处通入的是干燥的氯气 |
| A. | 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
| A. | NaOH═Na++O2-+H+ | B. | MgCl2═Mg2++Cl22- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NH4NO3═NH4++NO3- |
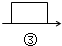 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤. 在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.