题目内容
3.(1)现有34g某气体,摩尔质量为17g•mol-1,则:①该气体为2mol.
②该气体所含分子数为2NA.
③该气体在标准状况下的体积为44.8L.
(2)①36 g H2O中的氧原子数目与标准状况下22.4L CO2中的氧原子数目相同.
②含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是0.6mol.
③已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为106g/mol.
分析 (1)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
(2)①根据n=$\frac{V}{{V}_{m}}$计算二氧化碳的物质的量,结合O原子数目相等计算水的物质的量,再根据m=nM计算水的总质量;
②由化学式可知,Al3+、SO42-的物质的量之比为2:3,据此计算;
③根据质量守恒计算C的质量,再根据M=$\frac{m}{M}$计算C的摩尔质量.
解答 解:①n=$\frac{34g}{17g/mol}$=2mol,故答案为:2;
②N=nNA=2mol×NA/mol=2NA,故答案为:2;
③V=nVm=2mol×22.4L/mol=44.8L,故答案为:44.8.
(2)①标准状况下22.4LCO2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,与之含有氧原子数目相同的水的质量为$\frac{1mol×2}{1}$×18g/mol=36g;
故答案为:36;
②由化学式可知,Al3+、SO42-的物质的量之比为2:3,0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是:0.4mol×$\frac{3}{2}$=0.6mol,
故答案为:0.6mol;
③根据质量守恒定律知,C的质量=(16+20-31.76)g=4.24g,C的摩尔质量=$\frac{4.24g}{0.04mol}$=106g/mol,故答案为:106g/mol.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
13.下列有关化学用语表示正确的是( )
| A. | 对烃基苯甲醛的结构简式: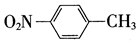 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: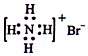 | D. | 二氧化碳分子的比例模型: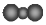 |
14.碳酸钠(Na2CO3)俗名纯碱,属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
11.乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成.有关物质的物理性质见表.合成过程如下:第一步:将丁醇和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯.
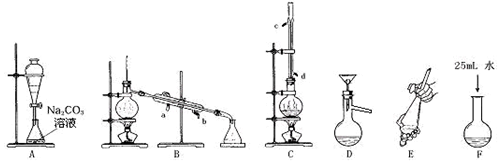
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
8.实验室欲配制480mL浓度为0.1mol•L-1的Na2CO3溶液,下列操作可以实现的是( )
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
15.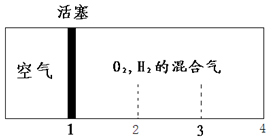 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )| A. | 7:2 | B. | 5:4 | C. | 3:1 | D. | 2:7 |
7.自然界地表层存在大量铁、铜的硫化物.现制得含氯化亚铁杂质的氯化铜水溶液,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按如图步骤进行提纯.
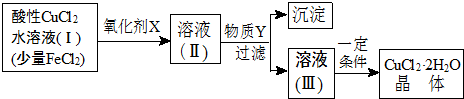
已知Cu2+、Fe3+和Fe2+的氢氧化物开始和完全沉淀时的pH,见表.请回答:
(1)加入氧化剂的目的是将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离.
(2)最适合作氧化剂X的是C(填序号).
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
在酸性条件下,氧化剂X与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2 H2O.
(3)加入的物质Y以调节溶液pH,Y的化学式是CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,pH的范围是调节溶液的pH至3.2~4.7.
(4)只能在HCl气流中加热浓缩才能得到CuCl2•2H2O晶体,HCl气流起的作用是:防止加热过程中CuCl2发生水解生成Cu (OH)2.
(5)已知Ksp(ZnS)>Ksp(CuS).地表层原生铜的硫化物经氧化、水浸作用后变成CuSO4溶液,再向地下深层渗透,遇到难溶的ZnS慢慢转变为铜蓝(CuS).用离子方程式解释ZnS能转变为CuS的原因Cu2+(aq)+ZnS(s)═Zn2+(aq)+CuS(s).

已知Cu2+、Fe3+和Fe2+的氢氧化物开始和完全沉淀时的pH,见表.请回答:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
(2)最适合作氧化剂X的是C(填序号).
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
在酸性条件下,氧化剂X与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2 H2O.
(3)加入的物质Y以调节溶液pH,Y的化学式是CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,pH的范围是调节溶液的pH至3.2~4.7.
(4)只能在HCl气流中加热浓缩才能得到CuCl2•2H2O晶体,HCl气流起的作用是:防止加热过程中CuCl2发生水解生成Cu (OH)2.
(5)已知Ksp(ZnS)>Ksp(CuS).地表层原生铜的硫化物经氧化、水浸作用后变成CuSO4溶液,再向地下深层渗透,遇到难溶的ZnS慢慢转变为铜蓝(CuS).用离子方程式解释ZnS能转变为CuS的原因Cu2+(aq)+ZnS(s)═Zn2+(aq)+CuS(s).
 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.