题目内容
11.如图是某同学设计的木炭和浓硫酸反应并检验所得全部产物的实验装置.已知酸性高锰酸钾溶液具有强氧化性,可将S元素从+4价氧化为+6价.请回答: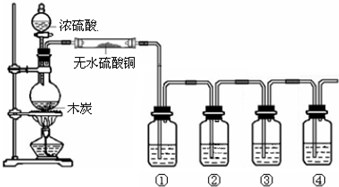
(1)浓硫酸与木炭在加热条件下发生反应的化学方程为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;若反应中共转移了0.4mol电子,则参加反应的硫酸的物质的量为0.2mol.
(2)图中4个洗气瓶装有的试剂请从下列药品中选择:澄清石灰水;酸性高锰酸钾溶液;品红溶液;(可重复选用)试指出各洗气瓶内试剂名称和作用:
①品红溶液,检验气体中含SO2;
②酸性高锰酸钾溶液,除去SO2气体;
③品红溶液,检验气体中含SO2是否除尽;
④澄清石灰水,检验CO2气体的存在.
分析 (1)浓硫酸和碳在加热条件下反应生成二氧化碳、二氧化硫和水;
(2)验证生成产物成二氧化碳、二氧化硫和水,需要先利用无水硫酸铜检验水蒸气的生成,依次检验二氧化硫气体,用品红试液褪色证明,②装置利用高锰酸钾溶液除去二氧化硫,③装置利用品红试液检验二氧化硫是否除净,④装置中利用澄清石灰水变浑浊证明二氧化碳的存在,据此回答.
解答 解:浓硫酸和碳在加热条件下反应生成二氧化碳、二氧化硫和水,验证生成产物成二氧化碳、二氧化硫和水,需要先利用无水硫酸铜检验水蒸气的生成,依次检验二氧化硫气体,用品红试液褪色证明,②装置利用高锰酸钾溶液除去二氧化硫,③装置利用品红试液检验二氧化硫是否除净,④装置中利用澄清石灰水变浑浊证明二氧化碳的存在.
(1)浓硫酸和碳在加热条件下反应生成二氧化碳,即C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,若反应中共转移了4mol电子,则参加反应的硫酸的物质的量为2mol,若反应中共转移了0.4mol电子,则参加反应的硫酸的物质的量为0.2mol,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,0.2;
(2)验证生成产物成二氧化碳、二氧化硫和水,需要先利用无水硫酸铜检验水蒸气的生成,依次检验二氧化硫气体,用品红试液褪色证明,②装置利用高锰酸钾溶液除去二氧化硫,③装置利用品红试液检验二氧化硫是否除净,④装置中利用澄清石灰水变浑浊证明二氧化碳的存在,
故答案为:①品红溶液;检验气体中含SO2;
②酸性高锰酸钾溶液;除去SO2气体;
③品红溶液;检验气体中含SO2是否除尽;
④澄清石灰水;检验CO2气体的存在.
点评 本题考查了浓硫酸性质的分析判断,产物的实验设计和实验验证方法、试剂选择、反应现象的判断,题目难度中等.

| A. | 200mL 2mol/L MgCl2溶液 | B. | 150mL 5mol/L KClO3溶液 | ||
| C. | 标准状况下,13.44L的HCl气体 | D. | 29.25gNaCl固体 |
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )a.D中不可能是浓硫酸 b.D中可以是少量水
c.通入的氯气含有水蒸气 d.D中可以是饱和食盐水.
| A. | abc | B. | bcd | C. | abd | D. | abcd |
 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①%2当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO4•7H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
2CH3CH2CH2CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式CH3CH2CH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、乙酸、正丁醇.
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为88%.
 在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )
在密闭容器中进行下列反应:M (g)+N (g)?R (g)+2L.此反应符合右面图象,下列有关叙述正确的是( )| A. | 正反应放热,L是气体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应放热,L不是气体 | D. | 正反应吸热,L不是气体 |
 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤. 浓硫酸是一种重要的化工产品.
浓硫酸是一种重要的化工产品.
