题目内容
乙醇是以高粱、玉米、薯类等为原料经发酵,蒸馏而值得,属于可再生资源.乙醇(C2H5OH)完全燃烧时生成CO2和H2O如果氧气不充足,乙醇燃烧可能还有CO生成,现用下图所示装置进行实验,确认乙醇燃烧产物中有CO、CO2和H2O.请回答下列问题:
(1)能确定产物中有H2O现象是 ;能确定产物中有CO的现象是 .
(2)实验时,可观察到装置B中石灰水无变化,B装置的作用是 ;C装置的作用是 ;D装置的作用是 .
(3)若乙醇燃烧产物中CO和CO2质量为25.2g,其中碳元素与氧元素质量比为2:5,则参加反应的乙醇质量为 g,产物中H2O的质量为 .
(4)科学家发现海底藏着大量的“可燃冰”-甲烷的水合物,质量相等的甲烷和乙醇在氧气充足的条件下完全燃烧,产生CO2质量较多的是 .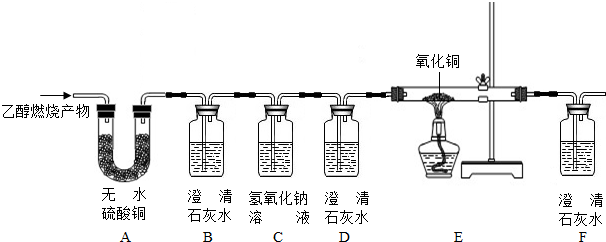
(1)能确定产物中有H2O现象是
(2)实验时,可观察到装置B中石灰水无变化,B装置的作用是
(3)若乙醇燃烧产物中CO和CO2质量为25.2g,其中碳元素与氧元素质量比为2:5,则参加反应的乙醇质量为
(4)科学家发现海底藏着大量的“可燃冰”-甲烷的水合物,质量相等的甲烷和乙醇在氧气充足的条件下完全燃烧,产生CO2质量较多的是

考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据白色的无水硫酸铜粉末与水反应生成蓝色的五水硫酸铜判断;根据一氧化碳的还原性和二氧化碳能使澄清的石灰水变浑的性质判断;
(2)根据二氧化碳能使澄清的石灰水变浑及实验验证的过程和要求解答;
(3)根据CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,求出碳元素的质量,再根据乙醇中碳的质量分数求乙醇的质量,最后根据乙醇中氢元素的质量与水中氢元素的质量相等和水中氢元素的质量分数求水的质量;
(4)根据甲烷和乙醇燃烧的化学方程式计算或根据碳元素反应前后质量不变,由二者的含碳量进行判断.
(2)根据二氧化碳能使澄清的石灰水变浑及实验验证的过程和要求解答;
(3)根据CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,求出碳元素的质量,再根据乙醇中碳的质量分数求乙醇的质量,最后根据乙醇中氢元素的质量与水中氢元素的质量相等和水中氢元素的质量分数求水的质量;
(4)根据甲烷和乙醇燃烧的化学方程式计算或根据碳元素反应前后质量不变,由二者的含碳量进行判断.
解答:
解:(1)白色的无水硫酸铜粉末与水反应生成蓝色的五水硫酸铜,如产物中有H2O生成,则A中的无水硫酸铜由白色变为蓝色;
一氧化碳有还原性,能把黑色的氧化铜还原成红色的铜,同时本身被氧化成二氧化碳,二氧化碳能使澄清的石灰水变浑,所以如是一氧化碳的话,现象应为的玻璃管中黑色的氧化铜变为红色,F中的澄清石灰水变浑浊,
故答案为:A中的无水硫酸铜由白色变为蓝色;玻璃管中黑色的氧化铜变为红色,F中的澄清石灰水变浑浊;
(2)证明二氧化碳存在,可根据二氧化碳能使澄清的石灰水变浑的性质,B装置的作用是验证产物中CO2的存在;一氧化碳的检验涉及与氧化铜反应生成二氧化碳,故在检验一氧化碳需先除去二氧化碳,再检验是否又生成了新的二氧化碳,所以C装置的作用是除去CO2;D装置的作用是检验CO2是否已除尽,
故答案为:验证产物中CO2的存在;除去CO2;检验CO2是否已除尽;
(3)CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,碳元素的总质量为25.2g×
=
7.2g,则乙醇中碳元素的质量也是7.2g,乙醇中碳的质量分数为
×100%=52.17%,乙醇的质量为7.2g÷52.17%=13.8g,乙醇中氢元素的质量为13.8g×
×100%=1.8g,则生成水中的氢元素也是1.8g,所以水的质量为
g=16.2g,
故答案为:13.8;16.2;
(4)甲烷和乙醇在燃烧时,它们中的碳都形成二氧化碳了,二者含碳量越高,产生二氧化碳的质量也越大,甲烷中碳的质量占
>乙醇中碳的质量占
,所以产生CO2质量较多的是甲烷,故答案为:甲烷.
一氧化碳有还原性,能把黑色的氧化铜还原成红色的铜,同时本身被氧化成二氧化碳,二氧化碳能使澄清的石灰水变浑,所以如是一氧化碳的话,现象应为的玻璃管中黑色的氧化铜变为红色,F中的澄清石灰水变浑浊,
故答案为:A中的无水硫酸铜由白色变为蓝色;玻璃管中黑色的氧化铜变为红色,F中的澄清石灰水变浑浊;
(2)证明二氧化碳存在,可根据二氧化碳能使澄清的石灰水变浑的性质,B装置的作用是验证产物中CO2的存在;一氧化碳的检验涉及与氧化铜反应生成二氧化碳,故在检验一氧化碳需先除去二氧化碳,再检验是否又生成了新的二氧化碳,所以C装置的作用是除去CO2;D装置的作用是检验CO2是否已除尽,
故答案为:验证产物中CO2的存在;除去CO2;检验CO2是否已除尽;
(3)CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,碳元素的总质量为25.2g×
| 2 |
| 2+5 |
7.2g,则乙醇中碳元素的质量也是7.2g,乙醇中碳的质量分数为
| 12×2 |
| 12×2+6+16×2 |
| 6 |
| 46 |
| 1.8 | ||
|
故答案为:13.8;16.2;
(4)甲烷和乙醇在燃烧时,它们中的碳都形成二氧化碳了,二者含碳量越高,产生二氧化碳的质量也越大,甲烷中碳的质量占
| 12 |
| 16 |
| 24 |
| 46 |
点评:能源、信息、材料、环境是当今世界四大首要问题,在能源危机日趋严重的今天,新能源的开发和利用,它既是社会热点,也是化学考查的热点,特别是氢能、乙醇汽油等.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
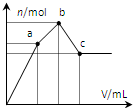 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法正确的( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法正确的( )| A、a点的溶液呈中性 |
| B、a点沉淀的质量比c点沉淀的质量大 |
| C、b点加入Ba(OH)2溶液的体积为250 mL |
| D、至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3?H2O+2H2O |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、pH相等的下列溶液①(NH4)2SO4、②NH4HSO4、③NH4Cl,c(NH4+)的大小关系为①=③>② |
| B、0.1mol/L的NaHA溶液,若pH=4,则溶液中存在:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、在NaHCO3和Na2CO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、在物质的量浓度之比为1:2的NaClO、NaHCO3的混合溶液中一定存在:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
下列说法正确的是( )
| A、石油的裂化属于物理变化 |
| B、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、蛋白质、脂肪和葡萄糖都可发生水解反应 |
| D、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
下列说法正确的是( )
A、相同条件下,结合质子的能力:OH->AlO2->CO32->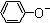 >HCO3->CH3COO- >HCO3->CH3COO- |
B、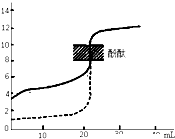 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入铁粉,经充分反应后铁粉完全溶解,过滤、洗涤、干燥得固体产物12.4g,则溶解的铁粉的质量是( )
| A、5.6 g |
| B、7 g |
| C、2.8 g |
| D、8.4 g |

 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).

